Molécule d'eau
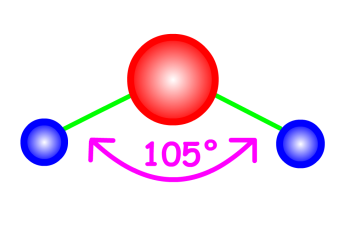
Examinons le cas de la molécule d'eau. Si on dénombre les modes de vibration, on trouve
Modes de libertés de la molécule | non linéaire exemple : \(\mathrm{H_2O}\) | \(\mathrm{H_2O}\) |
degrés de libertés | 3n | 3n = 3 x 3 = 9 |
modes de translation | 3 | 3 |
modes de rotation | 3 | 3 |
modes de vibration | 3n-6 | 9 - 6 = 3 |
On doit donc retrouver ces trois modes vibrationnels sur le spectre Infra Rouge de la molécule d'eau.
Cependant, comme la molécule d'eau est symétrique, et qu'elle ne possède qu'un seul type de vibrateur (\(\textrm{OH}\)), on devrait s'attendre à n'observer qu'une seule absorption. L'utilisation du modèle de l'oscillateur harmonique permet de déterminer que cette absorption se situe au-dessus de \(3000 ~\textrm{cm}^{-1}\).
Or, on prédit 3 absorptions par le calcul du nombre de vibrations... La suite va vous expliquer pourquoi il y en a 3.
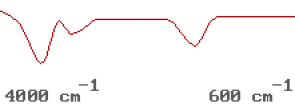
Regardons le spectre Infra Rouge de l'eau.Il présente 3 bandes d'absorption. Il y donc effectivement 3 modes de vibration comme le calcul le laisse prévoir. On note la présence de DEUX bandes d'absorption dans la région des \(3000~ \textrm{cm}^{-1}\). Nous allons déterminer pourquoi il y a deux bandes.
Nous avons considéré que seule la vibration \(\textrm{OH}\) était présente. En réalité, chaque élongation \(\textrm{OH}\) n'est pas isolée. Elle subit l'influence de l'autre puisque l'atome d'oxygène est commun et que les fréquences associées aux deux élongations \(\textrm{O-H}\) sont identiques. On parle alors de couplage.
En considérant les trois atomes simultanément, on peut décrire 2 modes vibrationnels distincts qui se produisent chacun dans le plan de la molécule
le premier mode correspond à une vibration en phase des deux liaisons \(\textrm{OH}\). Pour cette raison, ce mode de vibration est appelé vibration symétrique.
Impossible d'accéder à la ressource audio ou vidéo à l'adresse :
La ressource n'est plus disponible ou vous n'êtes pas autorisé à y accéder. Veuillez vérifier votre accès puis recharger le média.
le deuxième mode correspond à une vibration en opposition de phase. Ce mode de vibration est appelé vibration asymétrique.
Impossible d'accéder à la ressource audio ou vidéo à l'adresse :
La ressource n'est plus disponible ou vous n'êtes pas autorisé à y accéder. Veuillez vérifier votre accès puis recharger le média.
Le couplage des deux vibrateurs a pour effet de donner 2 bandes d'absorption, l'une de fréquence supérieure, l'autre de fréquence inférieure à la fréquence calculée par le modèle de l'oscillateur harmonique pour le vibrateur isolé.
On remarque sur le spectre que l'intensité de ces 2 bandes est différente. Pour comprendre cette différence d'intensité d'absorption, il faut examiner les deux modes de vibration d'élongation du point de vue de la variation du moment dipolaire de la molécule.
Rappel :
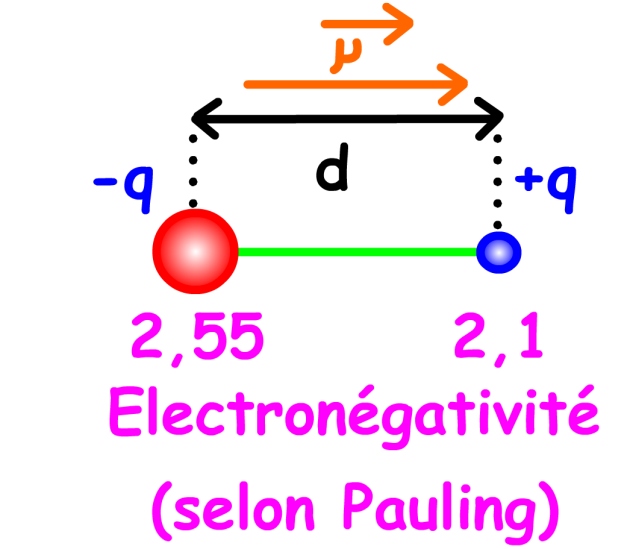
La différence d' électronégativité entre deux atomes liés crée une polarisation de la liaison.
Exemple \(\textrm{C-H}\), électronégativité \(\textrm C : 3\textrm,5\) et électronégativité \(\textrm H 2\textrm,1\). Du point de vue électrique, une liaison est assimilable à un dipôle, formé par l'ensemble des deux charges \(+\textrm q\) et \(-\textrm q\), situées à une distance \(\textrm d\) l'une de l'autre. Ce dipôle est caractérisé par son moment dipolaire \(\mu\).
Comme vous pouvez le voir, de ces deux modes de vibration d'élongation, celui qui correspond à la plus forte variation du moment dipolaire est la vibration d'élongation asymétrique.
Impossible d'accéder à la ressource audio ou vidéo à l'adresse :
La ressource n'est plus disponible ou vous n'êtes pas autorisé à y accéder. Veuillez vérifier votre accès puis recharger le média.
En effet, pour le mode de vibration en phase, seule l'intensité du moment dipolaire varie alors que pour le mode de vibration en opposition de phase, on observe à la fois une variation d'intensité mais aussi de direction.
Impossible d'accéder à la ressource audio ou vidéo à l'adresse :
La ressource n'est plus disponible ou vous n'êtes pas autorisé à y accéder. Veuillez vérifier votre accès puis recharger le média.
la partie haute (\(4000-1600 ~\mathrm{cm^{-1}}\)) correspond aux vibrations d'élongation,
la partie basse (\(1600- 600~ \mathrm{cm^{-1}}\)) correspond aux vibrations de déformation.
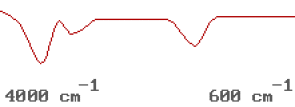
L'intensité associée à cette vibration dépend de la variation du moment dipolaire engendrée par la vibration.
Cette variation du moment dipolaire est plus faible que dans le cas de la vibration d'élongation asymétrique. Il n'est donc pas étonnant de trouver une intensité faible à la vibration de déformation associée à la molécule d'eau. Cette animation montre que le moment dipolaire varie uniquement en intensité.
Il reste une absorption dans la partie basse que nous n'avons pas encore associée à un mode de vibration. Cette vibration correspond à une déformation de l'angle des liaisons. De manière générale,
Impossible d'accéder à la ressource audio ou vidéo à l'adresse :
La ressource n'est plus disponible ou vous n'êtes pas autorisé à y accéder. Veuillez vérifier votre accès puis recharger le média.
Fondamental :
Il faut retenir que pour qu'une vibration moléculaire soit active en Infra Rouge, une modification du moment dipolaire doit être observée pendant la vibration.