Environnement alpha
Impossible d'accéder à la ressource audio ou vidéo à l'adresse :
La ressource n'est plus disponible ou vous n'êtes pas autorisé à y accéder. Veuillez vérifier votre accès puis recharger le média.
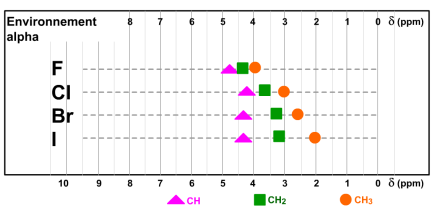
La position des signaux des protons diffère suivant leur environnement.
Voici les spectres de trois trihalométhanes. Nous observons que le signal du chloroforme est plus déblindé que celui du bromoforme, lui-même plus déblindé que celui de l'iodoforme.
Cette observation suggère un parallélisme entre l'échelle des ppm et celle des électronégativités.
Nous retrouvons la situation décrite dans le premier paragraphe sur la "théorie simplifiée" de la RMN pour les alcoxydes, les alcanes et les silanes.
Impossible d'accéder à la ressource audio ou vidéo à l'adresse :
La ressource n'est plus disponible ou vous n'êtes pas autorisé à y accéder. Veuillez vérifier votre accès puis recharger le média.
Si l'on substitue progressivement le méthane par des atomes d'halogènes, on observe que signal du chloroforme, est plus déblindé que celui du chlorure de méthylène. Celui-ci est lui-même plus déblindé que le signal du chlorure de méthyle.
En d'autres termes, l'augmentation du nombre d'halogènes portés par le carbone entraîne une diminution progressive de la densité électronique autour du proton, donc un déblindage de plus en plus important.
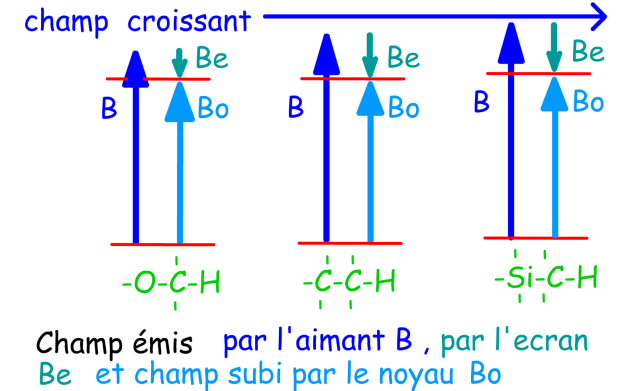
Voici un extrait de la table des déplacements chimiques en alpha. Nous y avons fait figurer les déplacements chimiques \(\delta\) des CH3 par un rond orange, des CH2 par un carré vert et des CH par un triangle violet.
Dans chaque cas, le carbone porteur d'hydrogène(s) est attaché à un halogène qui se trouve donc en position alpha.
Ce fragment de table représente les environnements alpha des halogènes.
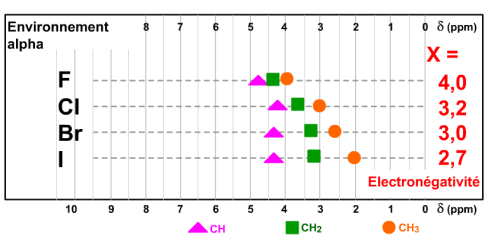
Examinons les halogénures de méthyle de formule CH3-X dont le déplacement chimique est figuré par un rond orange. Pour le fluorure, la résonance est atteinte à 4,2 ppm. L'électronégativité de cet halogène est égale à 4 ; elle est indiquée en rouge.
Pour l'iodure de méthyle, CH3-I, la résonance est atteinte à 2 ppm et l'électronégativité est de 2,7. Notez que le parallélisme entre l'échelle des électronégativités et celle des déplacements chimiques est d'autant moins nette que le carbone porte un plus grand nombre de chaînes alkyles.
Impossible d'accéder à la ressource audio ou vidéo à l'adresse :
La ressource n'est plus disponible ou vous n'êtes pas autorisé à y accéder. Veuillez vérifier votre accès puis recharger le média.
Le déplacement chimique donné par cette table pour un CH3 attaché à un atome de chlore Cl est de 3 ppm.
Sur le spectre expérimental du chlorure de méthyle CH3-Cl, observez le signal à 3 ppm.
Pour trouver la valeur d'un déplacement chimique d'un groupe de proton(s) situé en alpha d'une fonction chimique :
trouvez d'abord la ligne correspondant à la fonction chimique, puis
repérez s'il s'agit d'un groupe >CH-, -CH2- ou d'un groupe -CH3, et enfin,
notez la valeur du déplacement chimique observé pour ce groupe.
Vous devez absolument savoir utiliser cette table !
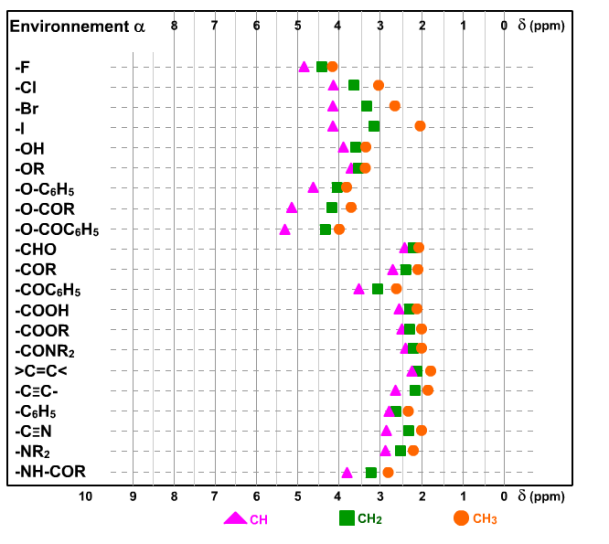
Réciproquement, si vous observez un signal vers 3,2 ppm pour lequel la courbe d'intégration vous permet d'attribuer 2 protons, deux possibilités s'offrent à vous :
soit, il s'agit de 2 groupes >CH- et dans ce cas, il faudra penser à une symétrie de la molécule car il est difficile d'imaginer avoir 2 groupes -CH< qui, avec des environnements différents, résonneraient au même champ...
soit, il s'agit d'un -CH2-...
Dans les deux cas, l'examen de cette table permet d'établir certaines hypothèses quant à l'environnement en alpha qui peut être prévu.
Ces tables seront précieuses pour toutes les interprétations de spectres de RMN du proton.
Au fur et à mesure de votre apprentissage en RMN, certaines valeurs seront assimilées... Ainsi vous retiendrez qu'un CH3 attaché à un carbone sp2 (trigonal) résonne toujours vers 2 ppm...
Mais surtout, n'apprenez pas par coeur les différentes valeurs observées !
Vous aurez toujours la possibilité de consulter ces tables...
Impossible d'accéder à la ressource audio ou vidéo à l'adresse :
La ressource n'est plus disponible ou vous n'êtes pas autorisé à y accéder. Veuillez vérifier votre accès puis recharger le média.
Du point de vue de la RMN, le groupe carboxyle -COO- se comporte comme un groupement composite, c'est-à-dire un assemblage de deux fonctions simples, la fonction carbonyle >C=O et la fonction alcoxyde -O-.
On peut vérifier le bien fondé de cette hypothèse en comparant entre eux les signaux des protons méthyles des quatre substances suivantes.
Impossible d'accéder à la ressource audio ou vidéo à l'adresse :
La ressource n'est plus disponible ou vous n'êtes pas autorisé à y accéder. Veuillez vérifier votre accès puis recharger le média.
Comme vous le voyez, le méthyle est fixé dans deux cas sur un carbonyle >C=O et dans deux autres sur un oxygène -O-.
Les méthyles fixés sur les carbonyles sont figurés en orange et violet. Ils sortent sensiblement au même champ que ceux de l'acétone, vers 2 ppm.
Les méthyles fixés sur les oxygènes alcoxydes sont figurés en vert et rouge. Il se comportent comme des méthoxyles classiques, sortant vers 3,5 ppm.
En résumé, on observe essentiellement des effets alpha. Comme vous le voyez, qu'il s'agisse de l'effet alpha d'un carbonyle ou de l'effet alpha d'un oxygène, les valeurs des déplacements chimiques sont légèrement affectés par l'environnement plus lointain (ici on a un effet en béta).
Nous retrouvons un comportement analogue à celui observé en infrarouge, où le vibrateur observé (groupe d'atomes, fonction) définit une zone précise du spectre IR, et l'environnement plus lointain entraîne des déplacements spécifiques à l'intérieur de cette zone.