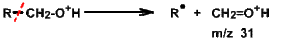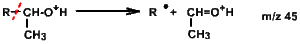Alcools
La propriété la plus remarquable de cette fonction est la "petitesse", voire même l'absence, du pic parent lors de l'utilisation d'une ionisation à 70eV. Le pic parent est donc très rare pour les alcools. Le pic P - 17 (correspondant à la perte de \(\textrm{OH}\)) est plus fréquent.
En général, pour les alcools primaires et secondaires, on trouve un pic important à P - 18, c'est à dire correspondant à la perte d'une molécule d'eau. Quand cette perte a lieu, on retrouve souvent ensuite les mêmes fragments que dans le spectre de l'alcène résultant de cette perte d'eau.
Comparez ces deux spectres... en haut celui de l'alcool, en-dessous, celui de l'alcène... on retrouve quasiment les mêmes fragments...
Les ions principaux donnés par les alcools sont obtenus par la coupure en \(\beta\) de l'oxygène (coupure de la liaison entre les atomes en \(\alpha\) et \(\beta\) de l'oxygène) (règle 8). Souvent, le pic associé à cette coupure est spécifique de la classe de l'alcool ; ainsi un ion 31 (\(\textrm{CH}_2\textrm{=OH}\)) pour un alcool est la preuve univoque d'un alcool primaire. On a :
Un ion 45 ( \(\textrm{CH}_3\textrm{-CH}^+\textrm{-OH}\)), pic de base dans le spectre d'un alcool, caractérise un alcool secondaire (méthyle porté par le \(\textrm C\) en \(\alpha\) du \(\textrm{OH}\)); a contrario, un alcool primaire non ramifié peut conduire à un ion 45 résultant d'un coupure en \(\gamma\) du \textrm{OH} (fragment \(\textrm{(CH}_2\textrm{-CH}_2\textrm{-OH)}^+\) mais cet ion sera de faible intensité et le pic de base sera alors le 31. On a :
Au-delà, dans le spectre d'un alcool, un pic de base à 59, (puis 73 ou toute variante en 31 + (n*14)), permet de rejeter l'alcool primaire mais peut correspondre soit à l'alcool tertiaire (diméthylé sur le \(\textrm C\) en du \(\textrm{OH}\)), soit à l'alcool secondaire portant un groupement éthyle sur ce même \(\textrm C\) en \(\alpha\). On a :
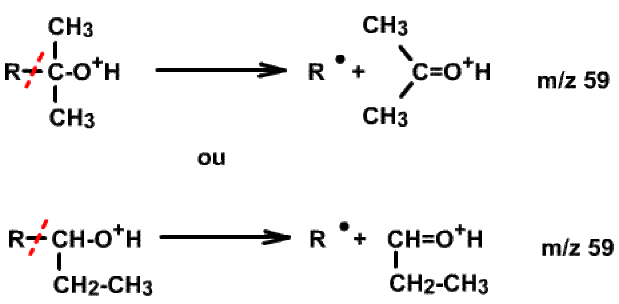
Pour un alcool secondaire ou tertiaire portant sur le carbone fonctionnel des groupements de tailles différentes, le pic de base est souvent associé à la perte du groupement le plus lourd. Ainsi par exemple, la perte du groupe éthyle \(\textrm{CH}_3\textrm{-CH}_2\textrm-\) (29) :
Notez que les masses des ions oxygénés (31, 45, 59, 73,...) sont supérieures de 2u aux masses des fragments des alcanes portant un carbone supplémentaire (29, 43, 57, 71, ...)
Ainsi, les alcènes, alcanes et alcools conduisent à des fragments de masse différant de 2u respectivement et donc parfaitement identifiables.