Nomenclature VSEPR
La forme de la figure de répulsion décrivant un atome dans une molécule dépend du nombre d'atomes auquels il se lie (les ligandes) et du nombre de ses paires libres.
Les atomes d'une molécule sont ainsi classés suivant leur type VSEPR, selon la formule générale :
\(\mathbf{\textrm{AX}_m\textrm E_n}\)
où \(\textrm A\) représente l'atome, \(\textrm X\) symbolise les \(\textrm m\) ligandes et \(\textrm E\) les \(\textrm n\) doublets non liants.
Les ligandes peuvent former une liaison simple, double ou triple avec l'atome central. Cela revient à considérer les liaisons doubles ou triples de la même façon que des liaisons simples ; elles sont localisées dans la même région de l'espace.
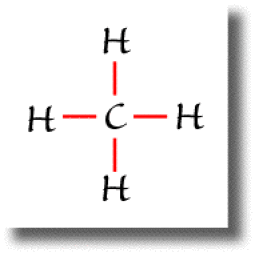
Dans la molécule de méthane \(\textrm{CH}_4\), l'atome de carbone est de type \(\textrm{AX}_4\).
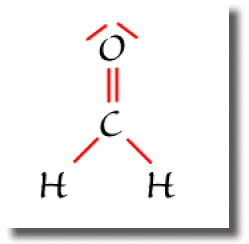
Dans la molécule de formaldéhyde \(\textrm H_2\textrm{CO}\), le carbone est entouré de 3 ligandes ; les deux paires liantes de la liaison \(\textrm C=\textrm O\) comptent pour une seule liaison.
L'atome de carbone est dans ce cas de type \(\textrm{AX}_3\).
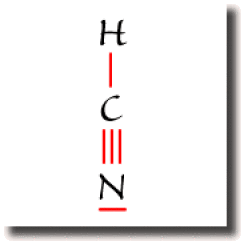
Dans la molécule d'acide cyanhydrique \(\textrm{HCN}\), le carbone est entouré de 2 liaisons seulement.
Cet atome de carbone est dans ce cas de type \(\textrm{AX}_2\).