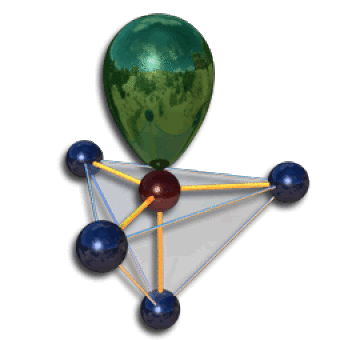
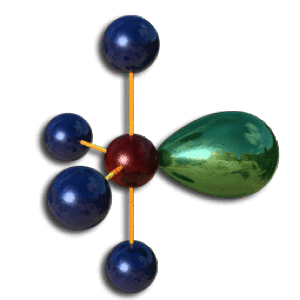
Position des paires non liantes
Dans le triangle et le tétraèdre, l'orientation des paires liantes et non liantes suivant les directions données par la figure de répulsion est indifférente. Ce n'est pas le cas dans la bipyramide trigonale et l'octaèdre.
Tout se passe comme si les paires non liantes étaient plus répulsives que les paires liantes.
Elles se positionnent alors dans l'espace de manière à former le plus grand angle possible avec les directions adjacentes de la figure de répulsion, et à s'éloigner le plus possible les unes des autres.
On distingue les orientations axiales et équatoriales, indiquées ci-contre dans le cas de la bipyramide trigonale.
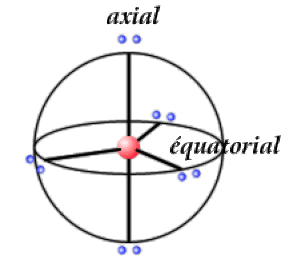
La bipyramide trigonale
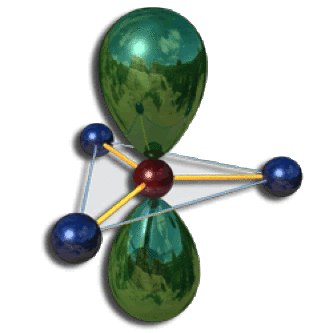
Les deux autres arrangements ci-dessous en pyramide trigonale et en triangle conduisent à une répulsion supérieure.

De la même façon, dans une structure de type \(\textrm{AX}_4\textrm E\) l'unique paire non liante peut occuper une position axiale ou équatoriale. En accord avec le principe énoncé ci-dessus, la position équatoriale est privilégiée. Deux liaisons forment des angles à 90 degrés avec la paire non liante, les deux autres étant à 120 degrés. La molécule prend la forme d'une bascule.
Dans la position axiale correspondant à une molécule pyramidale ci-dessous, la paire non liante est adjacente à trois paires liantes à 90 degrés. La répulsion est supérieure.