De la structure de Lewis aux hybrides : la molécule d'acétylène
Partie
Question
On considère la molécule d'acétylène \(\mathrm{C_2H_2}\).
Etablir le schéma de Lewis de la molécule et le type VSEPR des atomes de carbone.
En déduire la forme de la molécule et le type d'hybridation des atomes de carbone.
Etablir son schéma de liaison dans le modèle des liaisons de valence en décrivant les différents types de liaison : on tracera le schéma d'orbitales hybrides en y portant les différentes liaisons ainsi que le schéma de cases quantiques hybridées.
Aide simple
Le numéro atomique du carbone est Z = 6.
On rappelle qu'une liaison multiple dans le modèle de Lewis compte pour une seule liaison dans le modèle VSEPR.
Aide méthodologique
Il faut suivre l'ordre des questions de manière à pouvoir définir sans ambiguïté les orbitales (hybrides et non hybridées) des atomes de carbone.
La population des hybrides s'obtient en considérant le schéma de Lewis. Dans une paire liante, chaque électron est affecté à une des deux orbitales atomiques formant la liaison par recouvrement. Dans une paire liante, les deux électrons sont décrits par la même orbitale atomique.
Les règles VSEPR indiquent comment se positionnent les paires non liantes et les paires liantes. Elles indiquent par la même occasion comment placer les orbitales doublement occupées par rapport aux orbitales de liaison.
Solution détaillée
Le carbone possède 4 électrons de valence. L'hydrogène possède un électron de valence. Le schéma de Lewis de la molécule est donné ci-dessous :
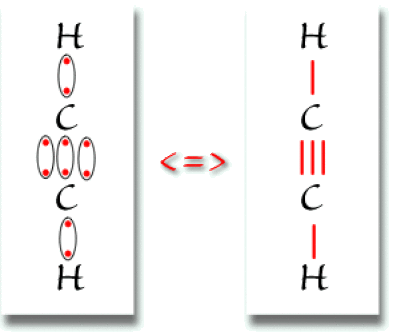
La liaison entre les deux atomes de carbone est une liaison triple.
Les deux atomes de carbone forment chacun deux liaisons au sens du modèle VSEPR : une liaison triple C-C et une liaison simple C-H. Il sont de type AX2. Leur figure de répulsion est linéaire et l'hybridation adaptée dans ce cas est de type sp. La molécule est donc linéaire.
Le schéma de recouvrement des orbitales est donné ci-dessous.
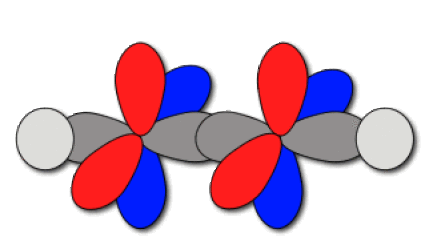
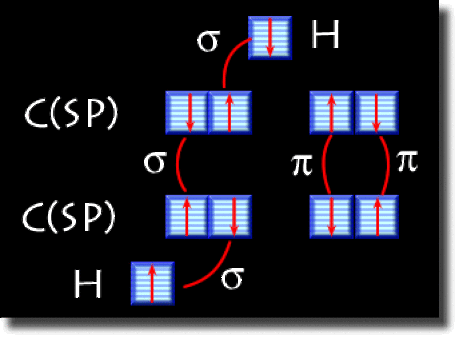
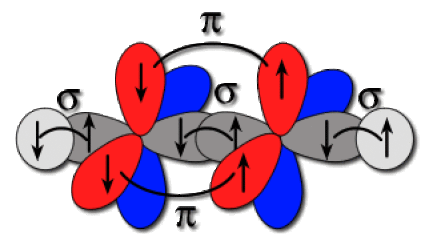
Le schéma des liaisons est reporté ci-dessous. Les électrons sont placés sur les orbitales de manière à rendre compte des liaisons du schéma de Lewis. Il se forme une liaison C-C axiale par recouvrement axial de deux hybrides du carbone. C'est une liaison \(\sigma.\) On forme aussi deux liaisons C-C de type\( \pi\) par recouvrement latéral des orbitales 2p non hybridées. Les liaisons C-H sont axiales de type \(\sigma\). Chaque liaison C-H est issue du recouvrement d'une hybride sp du carbone et de l'orbitale 1s de l'hydrogène voisin.
Le schéma de cases quantiques est une façon symbolique de représenter les liaisons. Il est donné ci-dessous. On utilise 2 cases hybridées sp et deux cases 2p pour le carbone.