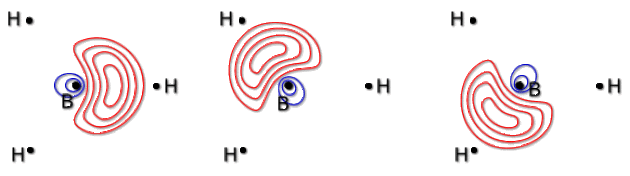
Construction des hybrides sp2
Partie
Question
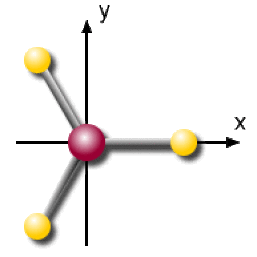
On considère la molécule \(\mathrm{BH_3}\). C'est une molécule plane que l'on place dans le plan \(\mathrm{xOy}\). L'angle entre les liaisons fait 120º. La molécule est placée dans le repère \(\mathrm{xOy}\) suivant la figure ci-contre. L'atome de bore est à l'origine du repère.
Les trois électrons de valence du bore sont décrits par trois orbitales hybrides \(\varphi_1~,\varphi_2\) et \(\varphi_3\) de type \(\mathrm{sp^2}\), composées des orbitales \(2\mathrm{p_x}\) ,\(2\mathrm{p_y}\) et\( 2\mathrm{s}\) de l'atome. Ces trois hybrides sont de même forme, mais orientées suivant les axes des liaisons BH.
L'angle d'hybridation 2s-2p dans ces hybrides dépend de l'écart d'énergie entre les orbitales 2s et 2p et de la force relative des interactions avec l'hydrogène. On note cet angle \(\alpha\) que l'on suppose connu (la valeur de \(\alpha\) dépend des approximations que l'on peut faire sur le calcul des énergies). \(\alpha\) est relatif au mélange de l'orbitale 2s et d'une orbitale 2p orientée suivant une liaison BH :
\(\varphi=\cos\alpha~2\mathrm{s}+\sin\alpha~2\mathrm{p}\)
Déterminer complètement la forme mathématique de ces 3 hybrides.
Aide simple
L'angle d'hybridation \(\theta\) entre deux orbitales \(\chi_\mathrm{A}\) et \(\chi_\mathrm{B}\) est défini par la forme de l'hybride \(\varphi\) :
\(\varphi=\cos\theta~\chi_{\mathrm{A}}+\sin\theta~\chi_B\)
On commencera par exprimer les orbitales 2p orientées suivant les liaisons en les exprimant comme combinaison des orbitales \(\mathrm{2p_x}\) et \(\mathrm{2p_y}\).
L'hybride alignée sur l'axe Ox est la plus simple.
Aide méthodologique
Chaque hybride est alignée suivant une liaison B-H : elle résulte du mélange de l'orbitale 2s et d'une orbitale 2p orientée suivant la liaison.
Une orbitale 2p orientée dans le plan est la combinaison normée des deux orbitales \(\mathrm{2p_x}\) et \(\mathrm{2p_y}\). L'angle d'hybridation est relié à l'angle de la liaison. On peut donc déterminer sans ambiguïté cette " hybridation\( \mathrm{p}^2\) ".
L'angle d'hybridation entre les orbitales 2p orientées et l'orbitale 2s est \(\alpha\). Il permet d'exprimer les hybrides \(\mathrm{sp^2}\) correctement orientées.
Aide à la lecture
Les orbitales hybrides s'écrivent comme combinaisons linéaires des orbitales atomiques \(\mathrm{2s}\), \(\mathrm{2p_x}\) et \(2\mathrm{p_y}\) du bore. Il s'agit de déterminer complétement les coefficients LCAO.
Solution détaillée
La première hybride est orientée suivant l'axe Ox. Elle ne contient alors que l'orbitale \(2\mathrm{p_x}\) et l'orbitale \(\mathrm{2s}\).
Elle s'exprime alors suivant l'expression :
\(\varphi_1=\cos\alpha~2\mathrm{s}+\sin\alpha~2\mathrm{p_x}\)
L'axe d'alignement de la seconde hybride est orienté d'un angle de 120º avec l'axe Ox. L'orbitale 2p orientée suivant cet axe est donc :
\(2\mathrm{p_{120}}=\cos~(120°)~2\mathrm{p_x}+\sin(120°)~2\mathrm{p_y}=-\frac{1}{2}~2\mathrm{p_x}+\frac{\sqrt{3}}{2}~2\mathrm{p_y}\)
L'hybride s'écrit alors :
\(\varphi_2=\cos\alpha~2\mathrm{s+\sin\alpha~2p_{120}=\cos\alpha~2s-\frac{sin~\alpha}{2}~2p_x+\frac{\sqrt{3}\sin\alpha}{2}~2p_y}\)
L'axe d'alignement de la dernière hybride est orienté d'un angle de -120º avec l'axe Ox. L'orbitale 2p orientée suivant cet axe est donc :
\(2\mathrm{p_{-120}=\cos~(-120°)~2p_x+\sin(-120°)~2p_y}=-\frac{1}{2}~2\mathrm{p_x}-\frac{\sqrt{3}}{2}~2\mathrm{p_y}\)
L'hybride s'écrit alors :
\(\varphi_3=\cos\alpha~2\mathrm{s+\sin\alpha~2p_{-120}=\cos\alpha~2s-\frac{sin~\alpha}{2}~2p_x-\frac{\sqrt{3}\sin\alpha}{2}~2p_y}\)