Interaction charge-dipôle
Considérons un ion placé à proximité d'une molécule possédant un moment dipolaire. Les interactions électrostatiques entre l'ion et les pôles plus et moins ne se compensent pas strictement car les distances entre l'ion et les charges partielles \(+\delta\) et \(-\delta\) ne sont pas équivalentes.
On peut établir l'expression de cette interaction en fonction du moment dipolaire \(\mu\) , de la distance entre l'ion et le centre de gravité de la molécule et de l'orientation \(\theta\) du dipôle par rapport au rayon molécule -ion, comme représenté ci-contre.
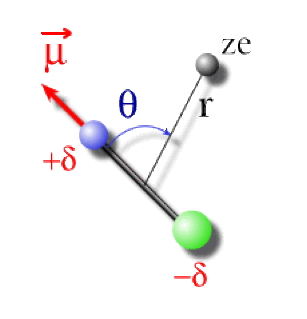
L'expression de cette énergie d'interaction charge-dipôle est alors la suivante :
\(\mathbf{E_\textrm{cd}(r)=-\frac{z.\textrm e.\mu}{4.\pi.\epsilon_0}\frac{\cos\theta}{r^2}}\)
Elle peut être positive ou négative suivant l'orientation relative des deux espèces.
Elles se positionnent alors de manière à développer une interaction attractive (\(<0\) ) maximale. Un ion positif se place alors préférentiellement du coté de la charge nette négative (\(\theta\ge \frac{\pi}{2}\)) alors qu'un anion se positionne préférentiellement du coté de la charge nette positive (\(\theta\leq\frac{\pi}{2}\)).
Impossible d'accéder à la ressource audio ou vidéo à l'adresse :
La ressource n'est plus disponible ou vous n'êtes pas autorisé à y accéder. Veuillez vérifier votre accès puis recharger le média.
Attraction pôle-dipôle
Cette interaction est à l'origine de la solvatation des composés ioniques dans les solvants polaires tels que l'eau, l'ammoniac, les alcools. Ainsi par exemple, lors de la dissolution du chlorure de sodium dans l'eau, les cations \(\textrm{Na}^+\) se séparent des anions \(\textrm{Cl}^-\) pour se positionner respectivement du coté négatif et positif des dipôles des molécules d'eau.
Remarque :
Les cations sont en général plus petits que les anions et peuvent donc se positionner plus près des molécules. L'interaction cation-dipôle est plus forte que l'interaction anion-dipôle.
Dans les gaz et les liquides, la mobilité des molécules due à l'agitation thermique conduit à faire une moyenne des interactions sur toutes les orientations possibles. On trouve alors une expression qui dépend de la température :
\(\mathbf{E_\textrm{cd}(r)=-\bigg(\frac{z.\textrm e.\mu}{4.\pi.\epsilon_0}\bigg)^2\frac{1}{6.\textrm k.T.r^4}}\)
où \(T\) est la température absolue (en Kelvin) et \(\textrm k\) est la constante de Boltzmann (\(\textrm k=\textrm{1,380662}.10^{-23} \textrm{J.K}^{-1}\)).