Liaison hydrogène intermoléculaire
La liaison hydrogène intermoléculaire joue un grand rôle dans la cohésion des phases condensées solides et liquides. Elle est aussi responsable de la formation d'agrégats dans la phase gaz. Elle est d'une très grande importance dans les systèmes biologiques.
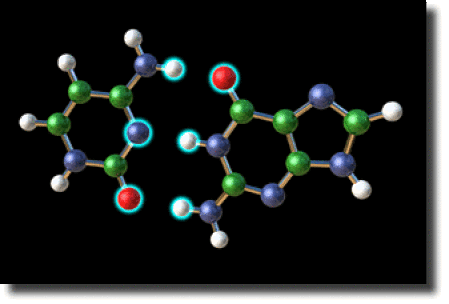
On a représenté ci-contre la liaison intermoléculaire entre la guanine et la cytosine, deux des quatre bases de l'ADN. La formation de ce complexe est due aux liaisons hydrogène \(\textrm N-\textrm{H--O}\) et \(\textrm N-\textrm{H---N}\) qui se développent entre les groupements fonctionnels de ces deux molécules. Les distances \(\textrm{C---O}\) et \(\textrm{N---H}\) sont de l'ordre de \(2 \stackrel{°}{\textrm A}\).
Complexe de la cytosine et de la guanine les atomes en interaction sont illuminés
Structure de la glace
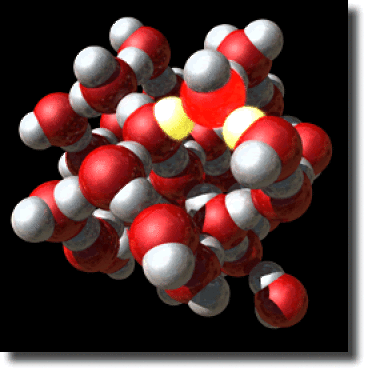
La liaison hydrogène est aussi à l'origine des propriétés particulières de l'eau. La structure cristalline de la glace est gouvernée par les liaisons hydrogène qui s'établissent entre chaque atome d'oxygène et deux hydrogènes appartenant aux molécules d'eau voisines. Les directions d'interaction correspondent à peu près aux directions de l'hybridation \(\textrm{sp}^3\) de l'oxygène.
Ce motif d'interaction est illuminé sur la figure ci-contre ainsi qu'une version animée.
A l'état condensé, la présence de liaisons hydrogène intermoléculaires conduit à une augmentation des points de fusion et d'ébullition, et une insolubilité dans les solvants apolaires comme le benzène ou le tétrachlorure de carbone \(\textrm{CCl}_4\).