Question 1
Durée : 8 mn
Note maximale : 11
Question
Les gaz réels vérifient l'équation d'état de Van der Waals :
\((p+\frac{a}{V^2})(V-b)=rT\)(écrite pour 1 gramme de gaz)
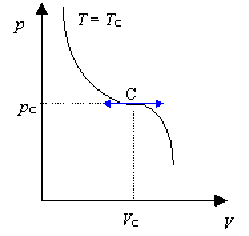
L'isotherme critique \(T = T_C\) (fig.), dans le diagramme \((p, V)\) présente, au point \(C (p_C,V_C,T_C),\) un point d'inflexion, à tangente horizontale.
Déterminer les deux relations liant \(V_C\) et \(T_C\) au point critique \(C.\)
Solution
A partir de l'équation de Van der Waals, nous tirons l'expression de :\(\color{blue}p=\frac{rT}{V-b}-\frac{a}{V^2}~~\color{red}\textrm{(1 point)}\)
Au point critique \((p_C,V_C,T_C)\) les dérivées \(\color{blue}\frac{dP}{dV}=\frac{d^2P}{dV^2}=0~~\color{red}\textrm{(2 points)}\) d'où :
\((\frac{dP}{dV})_{T=T_C}=0~~\textrm{soit}~~\color{blue}\frac{-rT_C}{(V_c-b)^2}+\frac{2a}{V_C^3}=0~~\color{black}(1)~~\color{red}\textrm{(4 points)}\)
\((\frac{d^2P}{dV^2})_{T=T_C}=0~~\textrm{soit}~~\color{blue}\frac{2rT_C}{(V_C-b)^3}-\frac{6a}{V_C^4}=0~~\color{black}(2)~~\color{red}\textrm{(4 points)}\)
