Isomérisation
L'acidité du proton α permet une tautomérie céto-énolique commune aux aldoses et cétoses.
La tautomérie est une transposition spontanée et réversible d'une molécule en un isomère de constitution. Si la transposition n'implique que le déplacement d'un hydrogène, on parle de prototropie. Tous les composés carbonylés portant au moins un hydrogène sur le carbone en α du carbonyle montrent ce phénomène. C'est donc le cas des oses (voir Bases structurales). En règle générale, la forme céto est plus stable, donc plus représentée que la forme énol.
Impossible d'accéder à la ressource audio ou vidéo à l'adresse :
La ressource n'est plus disponible ou vous n'êtes pas autorisé à y accéder. Veuillez vérifier votre accès puis recharger le média.
Complément :
Le passage de la forme céto à la forme énol nécessite le départ d'un hydrogène (en rouge) du carbone α et la protonation de l'oxygène, et réciproquement...
Dans le contexte de la tautomérie céto-énolique, les aldoses aussi bien que les cétoses sont considérés comme des formes céto, du fait de la présence d'un carbonyle. L'isomérisation réversible aldoses \(\leftrightarrow\) cétoses passe par une forme transitoire cis-ènediol (double énol) commune aux deux familles d'oses.
Impossible d'accéder à la ressource audio ou vidéo à l'adresse :
La ressource n'est plus disponible ou vous n'êtes pas autorisé à y accéder. Veuillez vérifier votre accès puis recharger le média.
Complément :
Les équilibres céto-énoliques du D-glucose et du D-fructose utilisent exactement la même forme double énol, qui sert d'intermédiaire à leur interconversion.
Complément :
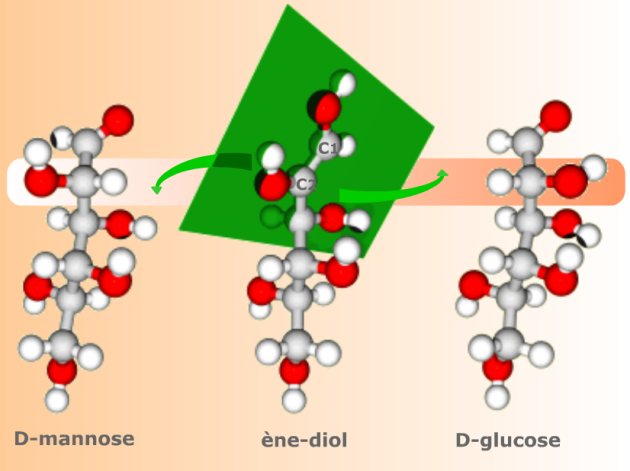
La planéité du groupe C1=C2 fait du cis-ènediol un intermédiaire commun aux deux formes céto épimères en C2, ici le D-glucose et le D-mannose.
Attention :
Cette possibilité d'épimérisation ne concerne qu'un carbone asymétrique adjacent au carbonyle, C2 des aldoses ou C3 des cétoses. Les autres carbones sont trop distants du carbonyle pour pouvoir bénéficier de la résonance du cis-ènediol. Leurs changements de configuration nécessitent d'autres stratégies, plus complexes.
Ces différentes isomérisations constituent la transformation de Lobry De Bruyn-Van Eckenstein, catalysée par les bases. En milieu alcalin et à chaud, cette transformation explique, par exemple, la réduction de la liqueur de Fehling par une solution de fructose (cétose non réducteur), via la transformation de ce dernier en glucose et mannose réducteurs (voir Oxydation des oses).
Ces équilibres spontanés sont moins favorisés dans les conditions de neutralité et de température de la cellule vivante.
Dans les conditions du milieu biologique, des enzymes contrôlent très spécifiquement la tautomérie céto-énolique et les isomérisations des oses qui en résultent.