Exemple n°6 suite
Soit un composé de formule brute \(\textrm C_7\textrm H_7\textrm F\) (4 centres d'insaturation).
Il est évident que dans ce composé en \(\textrm C_7\textrm H_7\textrm F\) tous les hydrogènes seront portés par des carbones (la solution\( \textrm{HF}\) étant hors de propos).
Il est néanmoins intéressant d'examiner le spectre OR (montrant les couplages \(\textrm{C-H}\))) qui, tout comme le spectre BB, présente le couplage du carbone au fluor. Le résultat est sans surprise : le carbone qui porte le fluor résonne toujours sous deux signaux séparés de 244 Hz (signaux à 157 et 169 ppm) sans aucune modification dans le spectre OR. On confirme ainsi la présence du motif \(\textrm{Csp}^2\textrm{-F}\). Regardez le spectre en couleurs ; c'est le doublet rouge...
On observe ensuite le signal d'un \(\textrm C\) non dédoublé par un couplage \(\textrm{C-H}\) (signal bleu) , c'est donc un carbone \(\textrm{Csp}^2\) porteur d'un groupement, sans doute le \(\textrm{CH}_3\) à 20 ppm. . On a ensuite un signal (violet) qui est dédoublé, donc \(\textrm{Csp}^2\textrm{-H}\). Le signal marron à 125 ppm doit correspondre à un carbone \(\textrm{sp}^2\) qui ne subit pas de couplage avec le \(\textrm F\) (ou du moins trop faible pour observer un dédoublement du signal). C'est un doublet dans le spectre OR, il s'agit donc d'un \(\textrm{Csp}^2\textrm{-H}\). Enfin deux doublest du spectre BB sont dédoublés dans le spectre OR. Il s'agit donc de \(\textrm{Csp}^2\textrm{-H}\) qui subissaient un couplage avec le \(\textrm F\). On reconnait facilement le \(\textrm{CH}_3\) à 20 ppm.
Dans le spectre DEPT, les raies issues d'un dédoublement par un couplage avec le fluor restent dédoublées. En effet la technique DEPT oeuvre dans le domaine de résonance du proton et n'intervient pas sur celui du fluor. Ainsi les deux raies doublet du \(\textrm{CF}\) (signal rouge dans le BB et OR) disparaissent ainsi que celles du carbone portant le second substituant (signal bleu), alors que les raies des \(\textrm{=CH}\) sont maintenues tout comme le signal du carbone \(\textrm{Csp}^3\).
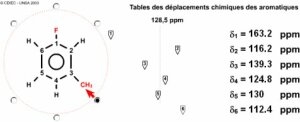
Le composé ne contenant pas d'hétéroatomes autres que le fluor (monovalent), tous les H sont portés par des carbones, 4 sont portés par les \(\textrm{Csp}^2\) et il en reste 3 pour le carbone \(\textrm{sp}^3\) c'est un \(\textrm{CH}_3\). Les couplages du fluor permettent de positionner ce dernier vis à vis des quatre carbones aromatiques :
le couplage de 20 Hz correspond à un \(\textrm{}^2\textrm J\) (carbones en ortho du carbone fluoré) et à deux \(\textrm{CH}\) dans ce composé
le couplage de 8 Hz correspond à un \(\textrm{}^3\textrm J\) (carbones en ortho du carbone fluoré) et à un \(\textrm{CH}\) et un \(\textrm C\) (porteur du second substituant) dans ce composé
le couplage de 2 Hz correspond à un \(\textrm{}^4\textrm J\) (carbone en para du carbone fluoré) et à un \(\textrm{CH}\) dans ce composé
Il apparaît que la sonde \(\textrm F \)donne, une fois identifiée, des informations complémentaires qui permettent d'écrire assez vite la solution. Il s'agit du méta fluoro toluène :