Les schémas de Lewis
La connaissance du nombre d'électrons et d'orbitales atomiques de valence disponibles permet de construire de façon imagée les arrangements des électrons de valence par paires. Chaque paire correspond à deux électrons appariés. On distingue les paires non liantes et les paires liantes.
Les électrons des paires non liantes appartiennent au même atome. Ces paires sont en général décrites par des orbitales doublement occupées de caractère atomique. L'oxygène dans la molécule de formaldéhyde ci-contre possède ainsi deux paires non liantes. Les électrons des paires liantes se partagent entre deux atomes voisins pour former des liaisons.
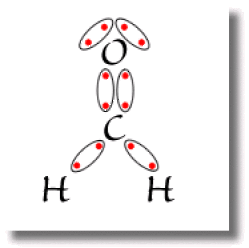
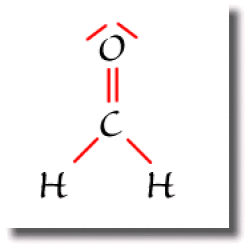
Deux atomes peuvent partager plusieurs paires. On dit alors qu'ils forment une liaison multiple. C'est le cas ci-contre pour la liaison double carbone-oxygène représentée ci-contre par deux traits joignant les atomes. L'atome d'hydrogène ne peut former que des liaisons simples.
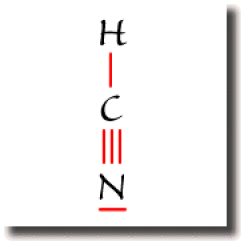
Dans la molécule \(\textrm{HCN}\), le carbone et l'azote forment une liaison triple et se partagent 6 électrons. L'azote possède une paire non liante.
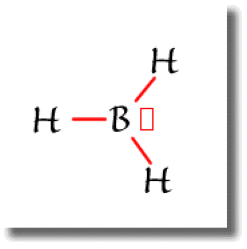
Dans la molécule \(\textrm{BH}_3\), le bore forme trois liaisons simples avec les atomes d'hydrogène. Les trois électrons qu'il fournit aux liaisons laissent une de ses quatre orbitales atomiques de valence innocupée, qu'on représente parfois sous la forme d'une case vide.