Compter les électrons
Il est important de savoir mener un inventaire des électrons de valence dans une molécule. Pour un atome donné, on distingue :
La population globale de l'atome dans la molécule, qui recense l'ensemble des électrons pouvant lui être affectés, les électrons liants partagés entre deux atomes ou les électrons non liants appartenant aux paires libres. Les règles de complétude portent sur cette population globale.
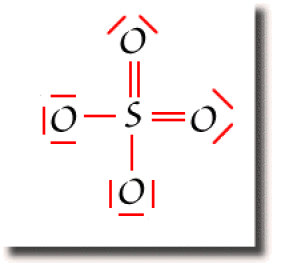
Exemple : L'ion SO42-
La figure ci-contre montre un schéma de Lewis pour l'ion \(\textrm{SO}_4^{2-}\), obtenu en saturant l'octet des oxygènes.
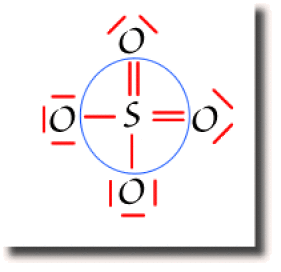
On montre ci-contre le décompte de la population globale de l'atome de soufre qui participe dans ce schéma à 6 liaisons. Il y a donc 6 paires liantes entourées d'un trait bleu. La population globale du soufre est de 12 électrons.
Les atomes d'oxygène apparaissent sous deux formes : simplement et doublement liés au soufre. Les oxygènes simplement liés possèdent 3 paires non liantes. Le décompte de la population globale est donc de 8 électrons. Ils respectent la règle de l'octet. Les oxygènes doublement liés possèdent 2 paires non liantes et leur population globale est aussi de 8 électrons. Ils respectent aussi la règle de l'octet.
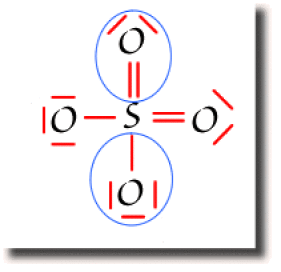
La population atomique au sens de Lewis qui n'affecte à l'atome qu'un seul électron par paire liante. On définit alors une charge formelle de Lewis. Cette charge nette de l'atome est définie par :
\(\textrm{charge nette}=\textrm{nombre d'électrons de valence}-\textrm{population atomique}\)
Exemple : L'ion SO42-
Ci-contre ne sont entourées de bleu que les moitiés des liaisons soufre-oxygène. On ne compte qu'un électron par paire liante. La population atomique de cet atome dans la molécule est alors de 6 électrons de valence. Le soufre atomique possédant 6 électrons de valence, sa charge nette dans la molécule est donc nulle sur ce schéma de Lewis.
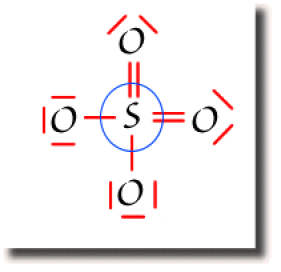
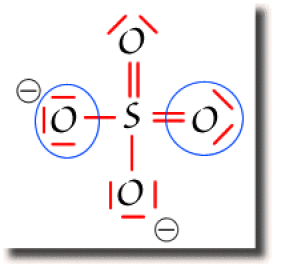
Le décompte sur les oxygènes est donné ci-contre.
Les oxygènes doublement liés ont une population atomique de 6 électrons et une charge nette nulle.
Les oxygènes simplement liés ont une population atomique de 7 électrons. Ils portent donc une charge nette négative indiquée sur la figure.
On définit un autre type de charge formelle pour chaque atome tenant compte de la différence d'électronégativité entre les deux atomes. Les deux électrons de chaque liaison sont alors affectés à l'élément le plus électronégatif. La charge nette atomique qui en résulte est équivalente au degré d'oxydation.
Exemple : L'ion SO42-
Pour déterminer les degrés d'oxydation, il faut considérer que l'oxygène est plus électronégatif que le soufre. On affecte donc aux oxygènes tous les électrons des liaisons qu'ils partagent avec le soufre, comme représenté ci-contre.
Quelle que soit la charge nette de l'oxygène, on lui attribue 8 électrons, soit un degré d'oxydation \(-\textrm{II}\) (noté conventionnellement en chiffres romains).
Dans ce décompte, le soufre a perdu ses 6 électrons de valence. Il est donc de degré d'oxydation \(+\textrm{VI}\).
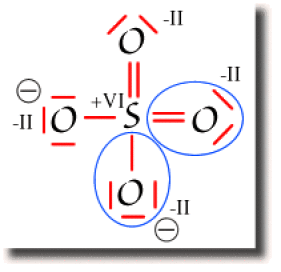
On vérifie que la somme des degrés d'oxydation des atomes composant la molécule est égale à la charge de la molécule.