Schémas résonants
On peut rencontrer un certains nombre de cas pour lesquels il existe plusieurs schémas possibles sans pouvoir privilégier l'un d'entre eux. Dans ce cas, la structure électronique de la molécule peut être vue de manière dynamique, comme résultant de la circulation de paires sur les atomes et les liaisons. On dit alors que la molécule obéit à un schéma résonant. Chaque structure de Lewis est appelée forme limite ou encore forme mésomère. La relation entre les diverses structures est appelée mésomérie.
Il en est ainsi :
lorsqu'on ne peut affecter le même type de paires liantes à des liaisons a priori équivalentes
Exemple : Le benzène
Dans le benzène \(\textrm C_6\textrm H_6\), chaque atome de carbone forme quatre liaisons pour compléter son octet. Si trois de ces liaisons s'établissent sans ambiguïté avec un atome d'hydrogène et deux atomes de carbone, la quatrième liaison peut se former avec l'un ou l'autre des carbones voisins. A l'échelle de la molécule, on trouve deux formules équivalentes mettant en jeu des liaisons entre atomes voisins uniquement. Ce sont les formules de Kékulé représentées ci-dessous.
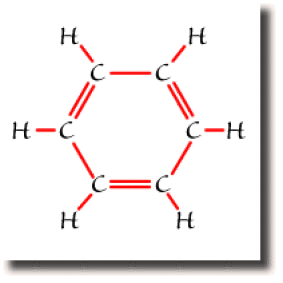
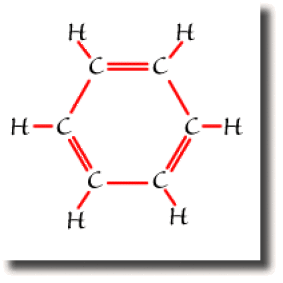
Ce sont les deux formules résonantes prépondérantes pour décrire le benzène.
On trouve aussi trois formules à liaison longue dites "de Dewar", dont l'une est représentée ci contre. Ces trois formules sont beaucoup moins importantes pour décrire le benzène, sans toutefois être négligeables.
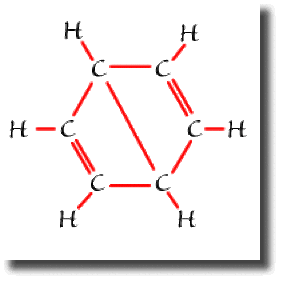
La structure électronique du benzène met donc en jeu une résonance entre 5 formules.
lorsque la règle de l'octet conduit à transférer des électrons d'un atome vers un parmi plusieurs atomes équivalents
Exemple : Le radical NO2
La figure ci-contre montre un schéma de Lewis pour \(\textrm{NO}_2\), obtenu en saturant l'octet de l'oxygène. Ce schéma n'est pas correct car la population globale sur l'azote atteint 9 électrons partagés, au delà de l'octet. Il faut donc rétablir le partage des électrons en transférant un électron de l'azote vers un des oxygènes. En transférant une paire liante sur un atome d'oxygène, le décompte de l'octet n'est pas modifié sur l'oxygène. Le transfert d'électron appauvrit néanmoins l'azote et la population atomique de l'oxygène augmente.
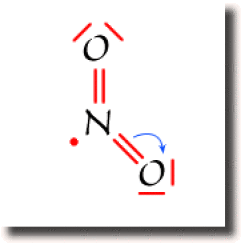
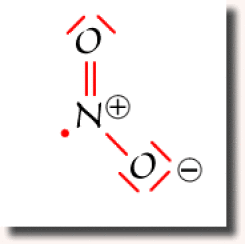
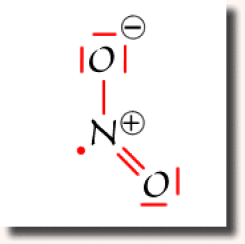
Suivant l'atome d'oxygène vers lequel s'est effectué le transfert, on obtient un des deux schéma de Lewis représentés ci-contre, dans lesquels aucun atome ne dépasse l'octet. Ce sont les deux schémas équivalents et prépondérants pour cette espèce chimique.
La structure électronique de \(\textrm{NO}_2\) doit donc être considérée comme une structure résonante qui traduit la mobilité de la liaison double \(\textrm N=\textrm O\).
On remarque dans ce cas l'apparition de charges partielles sur les atomes. L'apparition des charges est ici liée au transfert d'électron nécessaire pour ne pas violer la règle de l'octet sur l'azote.
Enfin, il faut noter que l'azote ne partage que 7 électrons. Son électron célibataire est disponible pour former une liaison avec un autre radical et compléter son octet.
lorsque un élément lourd peut conduire à des schémas respectant ou pas la règle de l'octet
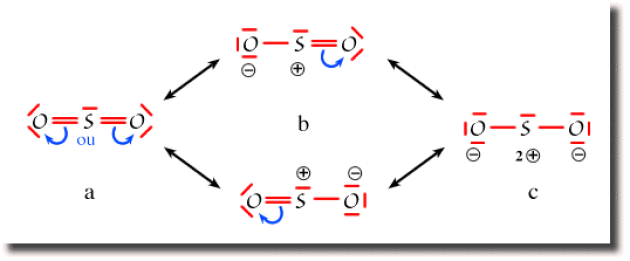
Exemple : L'ion SO2
Dans la molécule \(\textrm{SO}_2\), le premier schéma de Lewis (a) est obtenu en saturant l'octet des atomes d'oxygène. La population globale de l'atome de soufre atteint alors 10 électrons, au delà de l'octet, ce qui suppose que le soufre fait appel à une couche de valence étendue incluant les orbitales \(3\textrm d\). C'est le schéma prépondérant. Néanmoins, la structure électronique de la molécule est énergétiquement stabilisée par résonance avec des schémas respectant la règle de l'octet sur tous les atomes. Par transfert d'une paire liante vers un des oxygènes, on obtient les deux schémas équivalents (b) faisant apparaître des charges partielles sur le soufre et un des oxygènes. Ces schémas sont moins importants que le schéma (a) mais non négligeables. Un troisième schéma de Lewis (c) peut être tracé, qui fait apparaître une charge \(2+\) sur le soufre et une charge \(-\) sur chaque oxygène. Il est cependant de faible poids dans la résonance.
On distingue aussi deux formes de mésomérie :
la mésomérie covalente dans laquelle ne changent que les modes d'appariement des électrons sans transfert de charge d'un atome à l'autre, comme dans le benzène,
la mésomérie ionique dans laquelle les populations des atomes varient d'une forme limite à l'autre, comme pour \(\textrm{NO}_2\) ou \(\textrm{SO}_2\).