Les radicaux
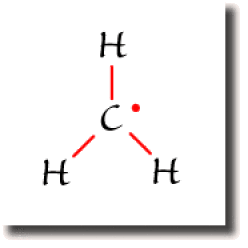
Dans le cas où le nombre d'électrons de valence de la molécule est impair, on ne peut apparier tous les électrons. Les règles de construction laissent alors un électron célibataire. La molécule est un radical.
Le radical CH3
Le radical PO2
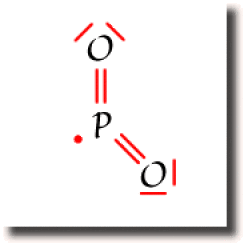
L'électron célibataire est susceptible de former une liaison avec un autre radical. Les radicaux sont donc des espèces fugaces car très réactives.
Il peut aussi arriver qu'une molécule à nombre pair d'électrons possède deux électrons célibataires. On a alors affaire à un diradical. C'est par exemple le cas du dioxygène \(\textrm O_2\). Le modèle de Lewis ne peut rendre rendre compte de l'existence des diradicaux pour lesquels un modèle orbitalaire plus rigoureux est nécessaire.