Filiation et série de Fischer
La grande majorité des oses naturels appartient à la série D de Fischer, mais des oses de série L existent également.
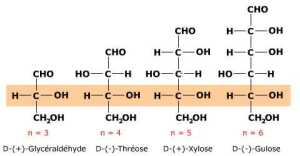
La détermination de la série de Fischer d'une molécule d'ose se fait par comparaison avec le glycéraldéhyde. Tout aldose dérive théoriquement d'un glycéraldéhyde par une ou plusieurs étapes d'insertion d'un chaînon asymétrique H-C-OH, selon le principe dit de la filiation des oses (voir Synthèse de Kiliani-Fischer pour les bases chimiques de cette filiation). Selon ce principe également, le carbone asymétrique sub-terminal (le plus éloigné de la fonction aldéhyde ou cétone) correspond, par filiation, au carbone asymétrique d'un glycéraldéhyde. La série de Fischer à laquelle appartient la molécule d'ose découle de l'observation de ce carbone sub-terminal, également appelé carbone de référence.
Tout ose, quelle que soit la longueur de son squelette carboné (n = ...), possède un carbone subterminal dit de référence (encadré) dont la configuration absolue correspond à celle d'un énantiomère de glycéraldéhyde. Tous les oses présentés ici appartiennent à la série D de Fischer.
L'ose appartient à la série D de Fischer si le carbone de référence a la même configuration absolue que le carbone asymétrique du D-(+)-glycéraldéhyde (OH à droite sur la projection de Fischer). A l'inverse, l'ose appartient à la série L si le carbone de référence possède la même configuration que le carbone asymétrique du L-(-)-glycéraldéhyde. Comme pour le glycéraldéhyde, la série de Fischer est indiquée par un D- ou un L- placé devant le nom de l'ose.
Rappel : La représentation de Fischer
La convention de Fischer est plus utilisée par les biochimistes que par les chimistes. Elle permet une simplification très significative de la nomenclature des monosaccharides.
Le carbone asymétrique étant identifié, il convient de placer la molécule dans une position précise, comme illustré ci-dessous.
Convention de Fischer
La molécule doit être observée dans une position bien précise:
le squelette carboné est vertical.
la fonction la plus oxydée (aldéhyde ou cétone) est orientée vers le haut.
les liaisons entre carbones s'éloignent de l'observateur (chaîne carbonée vers l'arrière).
dans cette position, les atomes formant l'alcool secondaire sont liés horizontalement au carbone asymétrique et sont dirigés vers l'observateur.
Dans le cas du glycéraldéhyde, c'est la position du groupe -OH de l'alcool secondaire qui détermine l'appartenance de la molécule à une série de Fischer : série D s'il apparaît à droite du carbone asymétrique, et série L s'il apparaît à gauche. Les deux énantiomères du glycéraldéhyde sont appelés D-(+)-glycéraldéhyde et L-(-)-glycéraldéhyde.
La formule de Fischer du glycéraldéhyde est une projection plane de ce que voit l'observateur lorsque la molécule est placée dans la position correcte. Une simplification de la projection de Fischer consiste à symboliser les alcools secondaires par un trait horizontal :
Formule de Fischer du D-glycéraldéhyde
Dans la formule simplifiée, l'hydroxyle du carbone 2 est symbolisé par un trait horizontal à droite (D) du squelette carboné. L'aldéhyde et l'alcool primaire sont toujours indiqués pour montrer l'orientation de la molécule.
La convention de Fischer décrit et nomme le glycéraldéhyde sur la base de la configuration absolue de son unique carbone asymétrique. La convention de Cahn, Ingold et Prelog décrit et nomme la configuration absolue du carbone asymétrique du glycéraldéhyde. Il existe une relation bien précise entre les deux conventions, qui permet d'aborder l'étude des molécules contenant plusieurs carbones asymétriques, et d'apprécier la diversité des oses.
Attention :
La série D ou L de Fischer ne préjuge en rien du caractère dextrogyre (+) ou lévogyre (-) de la molécule. Ainsi, le D-(+)-glucose est bien dextrogyre ( \([\alpha]_D^{20}\)= +52°), mais le D-(-)-fructose, lui, est fortement lévogyre ( \([\alpha]_D^{20}\)= -92,4°). C'est d'ailleurs de là que leur viennent leurs anciens noms de dextrose et de lévulose, respectivement.
De fait, l'activité optique d'une molécule est la somme algébrique des activités optiques des carbones asymétriques qui la composent !