Liaisons O-glycosidiques
La liaison O-glycosidique est un acétal formé entre deux oses.
La liaison O-glycosidique (ou, plus simplement, liaison glycosidique), est un acétal formé entre deux oses, dont l'un au moins implique obligatoirement son groupement hémi(a)cétal (voir Additions réversibles). Les oligosaccharides sont constitués de 2 à quelques 20 ou 30 unités osidiques, liées entre elles par des liaisons O-glycosidiques, selon de multiples combinaisons. Un disaccharide (ou dioside) est un oligosaccharide formé de 2 oses, un trisaccharide (ou trioside) est formé de 3 oses, etc... Une fois liées entre elles, les unités monosaccharidiques prennent les noms de reste, ou résidu (ce qui reste après élimination d'une molécule d'eau par le processus de condensation).
Attention :
Si la liaison O-glycosidique correspond bien chimiquement à une fonction condensée, sa formation in vivo est beaucoup plus complexe qu'une simple condensation, et fait appel à des réactions caractéristiques du métabolisme des glucides.
Tout résidu dont le carbone anomérique est pris dans une liaison glycosidique est un oside, et voit son nom systématique complété des suffixes -osyl ou -osido (à l'intérieur d'une structure) ou -oside (en bout de structure). Tout résidu dont le carbone anomérique reste libre garde son nom systématique avec la terminaison -ose.
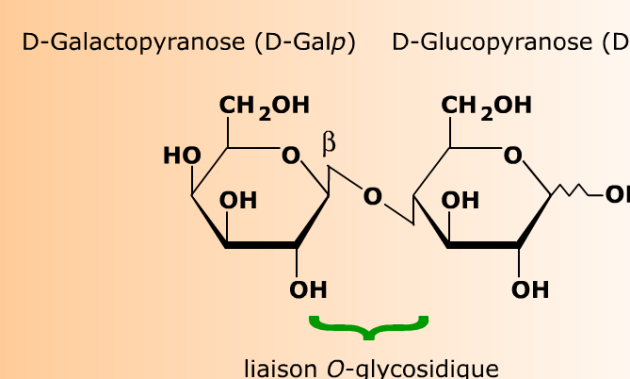
Le lactose est un disaccharide réducteur.
Complément :
Le lactose est génériquement un glycosyl glycose, et plus spécifiquement un galactosyl glucose, dans lequel la liaison O-glycosidique unit le carbone anomérique C1 d'un D-galactopyranoside au carbone C4 d'un D-glucopyranose. Le pouvoir réducteur et la mutarotation du glucose (à droite) sont symbolisés par la liaison en zig-zag de l'-OH hémiacétalique.
Dans le lactose, la liaison O-glycosidique unit le carbone anomérique C1 d'un D-galactopyranose au carbone C4 d'un D-glucopyranose. Le D-galactopyranose devient ainsi un résidu D-galactopyranosyle (un D-galactopyranoside) dont le carbone anomérique est verrouillé en configuration β. Le résidu de D-glucopyranose garde son carbone anomérique libre, conférant à la molécule son pouvoir réducteur, ainsi que la possibilité d'équilibrer les configurations anomériques α et β (mutarotation). Ces propriétés sont souvent représentées sur les formules par une liaison en zig-zag entre le carbone et l'hydroxyle hémiacétaliques.
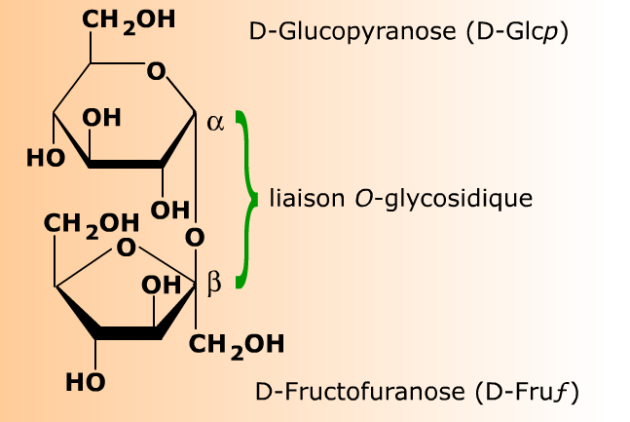
Le saccharose est un disaccharide non réducteur.
Complément :
Le saccharose est génériquement un glycosyl glycoside, et plus précisément un fructosyl glucoside, dans lequel la liaison O-glycosidique unit le carbone anomérique C2 d'un D-fructofuranoside au carbone anomérique C1 d'un D-glucopyranoside.
Dans le saccharose, la liaison glycosidique unit le carbone anomérique C1 d'un D-glucopyranose au carbone anomérique C2 d'un D-fructofuranose. Le D-glucopyranose devient ainsi un résidu de D-glucopyranosyle (un D-glucopyranoside) dont le carbone anomérique est verrouillé en configuration α. De la même manière le D-fructofuranose devient un résidu de D-fructofuranosyle (un D-fructofuranoside) dont le carbone anomérique est verrouillé en configuration β. Ne possédant aucun carbone anomérique libre, le saccharose ne réduit pas la liqueur de Fehling, et il ne montre pas de phénomène de mutarotation.