Effet chélate
Certains ligands présentent plusieurs atomes donneurs susceptibles de former des liaisons avec un atome métallique. Ce sont des ligands polydentes ou chélatants. Ces ligands, comme les ligands monodentes, sont susceptibles de former des complexes avec les métaux de transition. Ceux-ci présentent une stabilité particulière vis à vis des complexes de ligands monodentes. Cet effet stabilisateur est essentiellement un effet entropique. Plusieurs points de vue peuvent être adoptés pour expliquer cet effet entropique. Prenons comme exemple la réaction suivante, où un ion \(\textrm{Ni}^{2+}\) complexé par six ligands \(\textrm{NH}_3\) voit ceux-ci substitués par 3 ligands bidentes éthylènediamine (en) :
\([\textrm{Ni}(\textrm{NH}_3)_6]^{2+} + 3 .\textrm{en} \Leftrightarrow [\textrm{Ni}(\textrm{en})_3]^{2+} + 6. \textrm{NH}_3\)
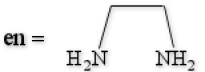
Dans les deux complexes mis en cause, les liaisons métal-ligand sont les mêmes (ce sont des liaisons métal-azote). Nous pouvons donc prévoir que la différence d'enthalpie de réaction sera petite.
En première approximation, on prévoit que la différence d'entropie de la réaction sera proportionnelle à la différence entre le nombre de molécules ou ions présents au début et à la fin de la réaction (augmentation du désordre). Ce nombre de particules augmente lorsque la réaction a lieu de gauche à droite et l'entropie de translation favorise donc l'obtention du système chélate plutôt que du système hexaammine.
Les valeurs déterminées expérimentalement confirment cette interprétation.
Exemple :
\([\textrm{Cu}(\textrm H_2\textrm O)_6]^{2+} + 2.\textrm{NH}_3\Leftrightarrow [\textrm{Cu}(\textrm H_2\textrm O)_4 (\textrm{NH}_3)_2]^{2+} + 2. \textrm H_2\textrm O\)
\(\Delta_\textrm n = 3 -3 = 0 ; \log \textrm K_1 = \textrm{7,7} ; \Delta_\textrm r \textrm H^0 = -46\textrm{ kJ.mol}^{-1} ; \Delta_\textrm r \textrm S^0 = +\textrm{8,4} \textrm{ J.K}^{-1} \textrm{mol}^{-1}\)
\([\textrm{Cu}(\textrm H_2\textrm O)_6]^{2+} + \textrm{en}\Leftrightarrow [\textrm{Cu}(\textrm H_2\textrm O)_4 (\textrm{en})]^{2+} + 2. \textrm H_2\textrm O\)
\(\Delta_\textrm n = 3 -2 = 1 ; \log \textrm K_1 = \textrm{10,6} ; \Delta_\textrm r \textrm H^0 = -54\textrm{ kJ.mol}^{-1} ; \Delta_\textrm r \textrm S^0 = +23 \textrm{ J.K}^{-1} \textrm{mol}^{-1}\)
Il existe une autre façon de voir l'effet entropique. Si une molécule d'ammoniac se dissocie du complexe, elle est rapidement entraînée dans la solution et la probabilité qu'elle revienne se lier au métal de transition est très faible. Inversement, si l'un des deux azotes de la molécule d'ethylènediamine se détache, la molécule reste accrochée au métal par le second azote et la probabilité qu'elle revienne à son point de départ est forte :
Impossible d'accéder à la ressource audio ou vidéo à l'adresse :
La ressource n'est plus disponible ou vous n'êtes pas autorisé à y accéder. Veuillez vérifier votre accès puis recharger le média.
L'effet chélate peut aussi être lié à des effets enthalpiques (donc énergétiques) dans quelques cas. Un cas particulier est la formation d'un cycle présentant un caractère aromatique : il existe alors une énergie de stabilisation de résonance. C'est le cas des complexes de la 2,4-pentanedione (appelée aussi acétylacétone ou acac). Les formes résonantes de l'acétylacétone déprotonée sont représentées ci-dessous.
Les métaux \(\textrm M\) au degré d'oxydation III, comme \(\textrm{Al}^{+3}\), \(\textrm{Cr}^{3+}\), \(\textrm{Ti}^{3+}\), \(\textrm{Co}^{3+}\) , sont susceptibles de former des complexes neutres avec l'acétylacétone déprotonée. Les liaisons \(\textrm M-\textrm O\) et \(\textrm C-\textrm O\) sont identiques et les formes de résonance pour un cycle sont représentées ci-dessous.
Notons que à la différence des cycles de la chimie organique, les cycles à cinq atomes sont généralement plus stables que les cycles à six atomes. En effet, l'atome métallique est plus gros que l'atome de carbone et les angles \(\textrm L-\textrm M-\textrm L\) sont de 90° dans les complexes plan-carré et octaédrique contre un angle optimum de 109,5° dans le carbone tétraédrique. Pour les cycles présentant des effets de résonance significatifs, les cycles à six atomes sont parfaitement stables.

