Introduction
Le comptage du nombre de carbones Nc et du nombre de pics Np est une étape décisive dans l'interprétation du spectre
Ainsi, en l'absence d'autres noyaux qui pourraient établir un couplage avec les noyaux de \(\textrm{}^{13}\textrm C\), et en évitant de prendre en compte les raies de la référence TMS (située à 0 ppm en général) et du solvant (3 raies pour \(\textrm{CDCl}_3\) ), grâce à ce comptage, on dispose d'une réponse immédiate et très utile pour la suite de l'interprétation sur la présence ou non de symétrie(s) dans le composé.
Deux situations sont possibles pour un composé possédant Nc atomes de carbone
on compte autant de pics Np (et donc de déplacements chimiques) que de carbones Nc, donc \(\textrm{Np = Nc}\). Dans ce cas, AUCUNE ISOCHRONIE ne concerne les carbones
on compte moins de pics que de carbones, on a Np < Nc. UNE ISOCHRONIE associe donc certains carbones et il y a lieu dans un premier temps de l'identifier.
Exemples :
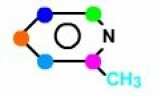
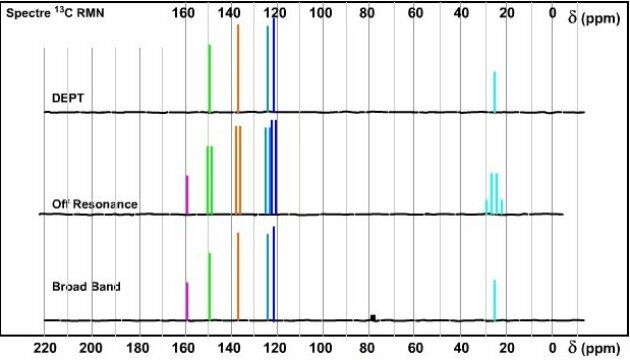
La formule présente 6 carbones donc Nc=6. Le spectre Broad Band présente 6 signaux, Np=6... on en déduit qu'il n'y a aucune isochronie des carbones. Np = Nc = 6
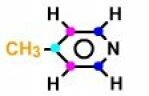
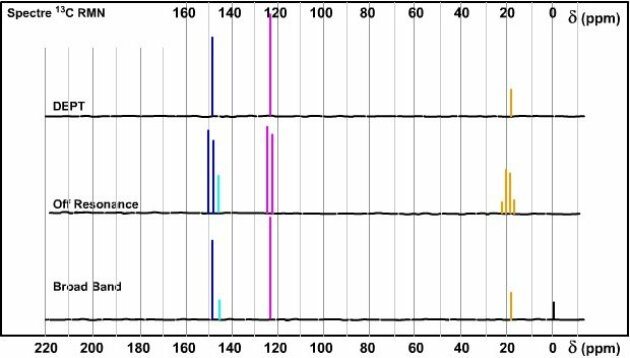
La formule présente 6 carbones donc Nc=6. Le spectre Broad Band présente 4 signaux, Np=4... on en déduit qu'il y a une symétrie moléculaire et donc une ou des isochronie(s) de certains carbones. Np < Nc. Dans le cas présent, on a une symétrie d'ordre deux (axe de symétrie passant par l'azote et le carbone situé en position \(\gamma\)). De ce fait les deux carbones en \(\beta\) de l'azote sont isochrones et donneront un seul signal. Il en est de même que les deux carbones en position \(\alpha\) de l'azote qui donneront également un même signal
Il y aura donc deux approches différentes selon ces deux situations
La méthodologie générale développée ci-dessous s'applique à des spectres dont la totalité des carbones est associable à un ensemble de déplacements chimiques, ce qui est directement le cas pour les composés ne présentant pas d'isochronie relative aux carbones. Pour les spectres présentant des signaux communs pour certains carbones, il y aura avant tout lieu d'identifier ces isochronies, ce qui n'est pas évident car on ne dispose pas de l'intégration en RMN du \(\textrm{}^{13}\textrm C\), l'outil simple présent en HMR. On devra donc traiter de la problématique de la présence d'une symétrie, soit partielle, soit d'ordre n, soit multiple, puis après cette « intégration qualitative » reprendre la méthodologie générale ; mais bien souvent la recherche de symétrie crée des implicites moléculaires qui s'inscrivent dans une méthode particulière, variante de la méthode générale.
On peut donc représenter l'alternative ainsi
Impossible d'accéder à la ressource audio ou vidéo à l'adresse :
La ressource n'est plus disponible ou vous n'êtes pas autorisé à y accéder. Veuillez vérifier votre accès puis recharger le média.
Il est évident que l'observation de Np > Nc relève des situations particulières suivantes
vous avez pris en compte des signaux supplémentaires tels ceux de la référence ou du solvant
le composé contient d'autres hétéronoyaux que \(\textrm{}^{1}\textrm H\) couplant le \(\textrm{}^{13}\textrm C\) tels que le \(\textrm{}^{19}\textrm F\), le \(\textrm{}^{31}\textrm P\),.
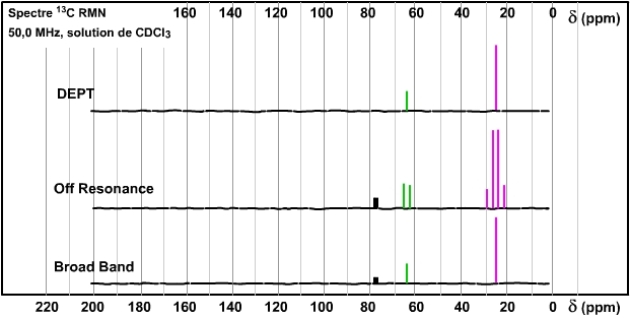
Nous illustrerons ce dernier cas plus loin, mais rappelons ici la nécessité de l'absence d'autres noyaux couplant afin de n'observer que des déplacements chimiques dans les spectres BB («Broad Band»). A ce propos, le cas de \(\textrm{CDCl}_3\) est exemplaire. Quelque soit le spectre (BB ou OR) on observe trois raies pour ce solvant ; elles représentent un carbone couplé avec un deutérium de spin nucléaire I = 1 et offrant trois moments magnétiques de même probabilité avec m = -1, 0 et 1. Ces raies sont insensibles à l'irradiation du proton. Exemple : les trois raies du solvant \(\textrm{CDCl}_3\) apparaissent dans les trois spectres de l'isopropanol.