Extension aux autres atomes
S'il y a plus de deux électrons, plusieurs orbitales sont peuplées.
Ainsi pour le lithium (\(\textrm Z=3\)) dans sa configuration fondamentale \(1\textrm s^2 2\textrm s^1\), il faut déterminer l'écran que subit un électron sur l'orbitale \(2\textrm s\) et celui que subissent les deux électrons \(1\textrm s\). Ces deux cas sont représentés ci-dessous en utilisant l'imagerie du modèle de Bohr et ses orbites électroniques circulaires.
Ecran agissant sur un électron 2s dans le lithium
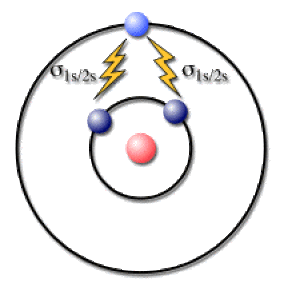
Ecran agissant sur un électron 1s dans le lithium
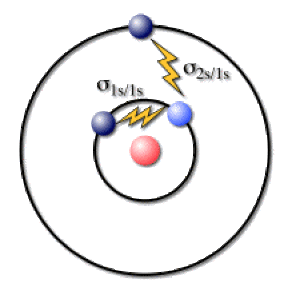
Dans l'approximation de Slater, les électrons externes n'exercent pas d'effet d'écran sur les électrons internes. Par conséquent, la constante d'écran \(\sigma_{2\textrm s/1\textrm s}\) est nulle.
Un jeu standard de constantes d'écran dépendant des nombres quantiques relatifs des orbitales en jeu permet d'obtenir des valeurs satisfaisantes des charges effectives pour chaque orbitale occupée dans les atomes polyélectroniques. Ce jeu est donné dans le tableau ci-dessous.
Groupe d'origine de l'électron | Contributions des autres électrons | |||||
|---|---|---|---|---|---|---|
Couches n-2, n-3, ... | Couche n-1 | Couche n | Couches supérieures | |||
s,p | d | f | ||||
s,p | 1,0 | 0,85 | 0,35* | 0,0 | 0,0 | 0,0 |
d | 1,0 | 1,0 | 1,0 | 0,35 | 0,0 | 0,0 |
f | 1,0 | 1,0 | 1,0 | 1,0 | 0,35 | 0,0 |
* sauf entre 2 électrons 1s (0,31)
Pour des calculs précis, des charges effectives optimisées on été calculées par Clementi et Raimondi.
Exemple : Exemple de calcul pour l'atome de Lithium
On écrit donc : \(\textrm E=2.\epsilon_{1\textrm s}+\epsilon_{2\textrm s}\)
Les énergies des orbitales sont données par :
\(\epsilon_{1\textrm s}=-\textrm{13,6}.(\textrm Z^*_{1\textrm s})^2\)
\(\epsilon_{2\textrm s}=-\textrm{13,6}.\frac{(\textrm Z^*_{2\textrm s})^2}{4}\)
La charge effective pour l'électron \(2\textrm s\) s'écrit :
\(\textrm Z^*_{2\textrm s}=\textrm Z-2.\sigma_{1\textrm s/2\textrm s}\)
Celle que voit un électron \(1\textrm s\) :
\(\textrm Z^*_{1\textrm s}=\textrm Z-\sigma_{1\textrm s/1\textrm s}-\sigma_{2\textrm s/1\textrm s}\)
L'application numérique donne alors : \(\textrm E(\textrm{Li})=\textrm{202,4 eV}\).
De la même manière, on trouverait pour le cation \(\textrm{Li}^+\) : \(E(\textrm{Li}^+)=\textrm{196,7 eV}\).
Dans ce cation, l'énergie de l'orbitale \(1\textrm s\) doublement occupée est la même que dans l'atome neutre.
L'énergie d'ionisation calculée est donc \(\textrm I_1=\textrm E(\textrm{Li}^+)-\textrm E(\textrm{Li})=-\epsilon_{2\textrm s}=\textrm{5,7 eV}\) ce qui est proche de la valeur expérimentale \(\textrm I_1=\textrm{5,39 eV}\).