Détermination des orbitales
On applique le principe des variations aux électrons de l'atome. L'hamiltonien est l'hamiltonien exact qui inclue explicitement les termes de répulsion entre électrons.
On choisit a priori comme fonction d'onde approchée le déterminant de Slater introduit précédemment dans le modèle des électrons indépendants. L'adaptation de cette fonction d'onde au problème posé peut être notablement améliorée si l'on cherche à optimiser les orbitales dans le déterminant. C'est l'essence de la méthode de Hartree-Fock. Ces orbitales optimisables se présentent sous la forme d'orbitales atomiques :
\(\mathrm{\phi_{n l m}(r,\theta,\phi)=R_{n l}(r).\Theta_{l m}(\theta).\Phi_m(\phi)}\)
où la partie angulaire est une fonction angulaire hydrogénoïde. En revanche la fonction radiale \(\mathrm{R_{n l}}\) est différente.
Une manière simplifiée de rendre compte de l'optimisation de l'orbitale lorsque l'on passe du modèle hydrogénoïde au modèle polyélectronique est de faire appel aux constantes d'écran. Comme dans le modèle de Slater, on prend des parties radiales hydrogénoïdes en remplaçant le numéro atomique \(\textrm Z\) par un paramètre ajustable \(\alpha\) que l'on assimile aussi à la charge effective : c'est la charge globale que "voit" un électron de l'atome. Elle intègre donc la charge du noyau (\(\textrm Z>0\)) mais aussi la charge moyenne (\(<0\)) due aux autres électrons qui sont ici décrits par des orbitales.
On écrit de même que dans le modèle de Slater :
\(\alpha=\textrm Z-\sigma\)
où \(\sigma\) est la constante d'écran (\(\sigma>0\)) caractéristique de l'atome et de l'orbitale considérée. Mais, à la différence du modèle de Slater, les électrons sont tous traités de manière quantique simultanément ; la charge effective donnée par \(\alpha\) n'est ici qu'un artifice mathématique qui ne suppose pas que l'on a fondu le noyau et les autres électrons en une charge ponctuelle effective \(\alpha\).
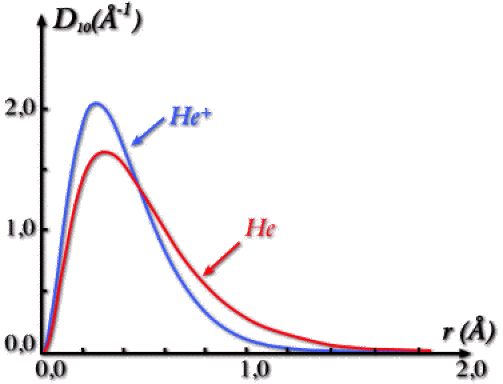
On a représenté ci-dessous, à titre de comparaison, la densité radiale de l'orbitale \(1\textrm s\) de \(\textrm{He}^+\) et celle de \(\textrm{He}\).
L'orbitale est optimisée suivant une modélisation plus sophistiquée correspondant à une expression mathématique de l'orbitale plus compliquée mais plus facilement adaptable que l'expression hydrogénoïde.
La densité radiale dans \(\textrm{He}\) s'étend plus loin du noyau que la densité de l'orbitale hydrogénoïde de \(\textrm{He}^+\). On constate ainsi que l'interaction entre les deux électrons \(1\textrm s\) se traduit par un gonflement de l'orbitale.
On retiendra que pour décrire l'interaction répulsive entre les électrons, on conserve la notion d'orbitale, mais on laisse "respirer" ces dernières pour qu'elles intègrent la répulsion électronique.