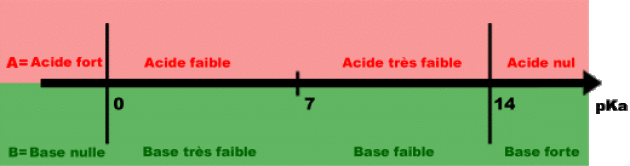
Classement des acides (ou bases) forts ou faibles dans l'eau
Réaction d'un acide A dans l'eau pure
Dans l'eau pure, les 2 espèces conjuguées de \(\textrm H_2\textrm O\), \(\textrm H_3\textrm O^+\) et \(\textrm{OH}^-\), sont elles-mêmes respectivement un acide[1] et une base[2]. Ces deux ions sont donc associés à deux couples acide - base[3] et donc à deux constantes d'acidité[4]. La réaction d'acidité d'un acide \(\textrm A\) appartenant au couple \(\textrm{A / B}\) est
\(\textrm A + \textrm H_2\textrm O \Leftrightarrow \textrm B + \textrm H_3\textrm O^+\)
La réaction d'acidité de l'acide \(\textrm H_3\textrm O^+\) appartenant au couple \(\textrm H_3\textrm O^+\textrm{/ }\textrm H_2\textrm O\) sera donc :
\(\textrm H_3\textrm O^+ + \textrm H_2\textrm O \Leftrightarrow \textrm H_2\textrm O + \textrm H_3\textrm O^+\)
Cette réaction d'acidité a une constante d'acidité égale à 1 car le quotient réactionnel[5] \(\textrm Q\) associé à cette réaction vaut 1 puisque les composés formés sont identiques aux réactifs consommés.
On a donc pour l'acide \(\textrm H_3\textrm O^+\) \(\mathbf{\textrm{ }\textrm Q = \textrm K_\textrm a = 1\textrm{ ou encore }\textrm{pK}_\textrm a=0}\)
Acides forts et acides faibles
Considérons un acide \(\textrm A\) correspondant à un couple acide-base de \(\textrm{pK}_\textrm a < 0\textrm{ }(\textrm K_\textrm a > \textrm1)\).
D'après les lois de la thermodynamique, cela signifie que la réaction \(\textrm A + \textrm H_2\textrm O \Leftrightarrow \textrm B + \textrm H_3\textrm O^+\) se déplace spontanément vers la droite dans les conditions standards \((\Delta_rG^0 < 0)\).
Pour les concentrations en acide habituellement rencontrées c'est à dire pour des concentrations nettement inférieures à 1 mol.L-1, on peut montrer alors que la réaction est quasi totale.
Un acide \(\textrm A\) appartenant à un couple acide-base de \(\textrm{pK}_\textrm a\) négatif sera donc totalement transformé en ions \(\textrm H_3\textrm O^+\) : on dit qu'il s'agit alors d'un acide fort.
Un acide \(\textrm A\) appartenant à un couple acide-base de \(\textrm{pK}_\textrm a\) positif ne sera que partiellement transformé en ions \(\textrm H_3\textrm O^+\) : on dit qu'il s'agit alors d'un acide faible.
Conséquences (pour les concentrations habituelles : << 1 mol.L-1) :
un acide fort \(\textrm A\) est totalement dissocié. Cela veut dire que toutes les molécules de \(A\) introduites dans l'eau sont totalement transformées en ions \(\textrm H_3\textrm O^+\) et en sa base conjuguée \(\textrm B\) . La réaction \(\textrm A + \textrm H_2\textrm O \to \textrm B + \textrm H_3\textrm O^+\) est totale.
la base conjuguée \(\textrm B\) d'un acide fort \(\textrm A\) est inerte (elle ne peut pas capter de proton) ; on peut alors parler de base " nulle " puisque n'ayant aucune propriété basique.
un acide faible \(A\) est partiellement dissocié. Cela veut dire que parmi les molécules de \(\textrm A\) introduites dans l'eau toutes ne sont pas transformées en ions \(\textrm H_3\textrm O+\) et en sa base conjuguée \(\textrm B\) . La réaction \(\textrm A + \textrm H_2\textrm O \Leftrightarrow \textrm B + \textrm H_3\textrm O^+\) est partielle.
la base conjuguée \(\textrm B\) d'un acide faible \(\textrm A\) est une base faible ; cela signifie qu'elle ne réagit pas totalement avec les ions \(\textrm H_3\textrm O^+\) présents dans l'eau.
aucun acide plus fort que \(\textrm H_3\textrm O^+\) n'existe en solution et donc tous les acides forts ont le même comportement acido-basique en solution (on emploie habituellement l'expression de "nivellement par le solvant" pour rendre compte de ce comportement)
Réaction d'une base dans l'eau
La réaction de basicité d'une base B appartenant au couple A / B est
\(\textrm B + \textrm H_2\textrm O \Leftrightarrow \textrm A + \textrm{OH}^-\)
La réaction de basicité de la base OH- appartenant au couple H2O / OH- sera donc :
\(\textrm{OH}^- + \textrm H_2\textrm O \Leftrightarrow \textrm H_2\textrm O + \textrm{OH}^-\)
Cette réaction de basicité a une constante de basicité Kb égale à 1 car le quotient réactionnel Q associé à cette réaction vaut 1 puisque les composés formés sont identiques aux réactifs consommés.
On a donc pour la base OH- \(\mathbf{\textrm{ }Q = K_b = 1 \textrm{ soit puisque } K_a.K_b = K_e = 10^{-14}}\)
Soit Ka = 10-14 ou encore pKa = 14
Bases fortes et faibles
Pour les concentrations en acide habituellement rencontrées c'est à dire pour des concentrations nettement inférieures à 1 mol.L-1, on peut montrer alors que la réaction est quasi totale.
Une base \(\textrm B\) appartenant à un couple acide-base de \(\textrm{pK}_\textrm a\) supérieur à 14 sera donc totalement transformée en ions \(\textrm{OH}^-\) : on dit qu'il s'agit alors d'une base forte.
Une base \(\textrm B\) appartenant à un couple acide-base de \(\textrm{pK}_\textrm a\) positif ne sera que partiellement transformé en ions \(\textrm{OH}^-\) : on dit qu'il s'agit alors d'une base faible.
Conséquences (pour les concentrations habituelles : << 1 mol.L-1) :
une base forte \(\textrm B\) est totalement dissociée. Cela veut dire que toutes les molécules de \(\textrm B\) introduites dans l'eau sont totalement transformées en ions \(\textrm{OH}^-\)et en son acide conjugué \(\textrm A\) . La réaction \(\textrm B + \textrm H_2\textrm O \to \textrm A + \textrm{OH}^-\) est totale.
l'acide conjugué d'une base forte est inerte (il ne peut pas céder de proton) on peut alors parler d'acide " nul " puisque n'ayant aucune propriété acide.
une base faible est partiellement dissociée. Cela veut dire que parmi les molécules de \(\textrm A\) introduites dans l'eau toutes ne sont pas transformées en ions \(\textrm{OH}^-\) et en son acide conjugué \(\textrm A\) . La réaction \(\textrm B + \textrm H_2\textrm O \Leftrightarrow \textrm A + \textrm{OH}^-\) est partielle.
l'acide conjugué d'une base faible est un acide faible.
aucune base plus forte que \(\textrm{OH}^-\) n'existe en solution et donc toutes les bases fortes ont le même comportement en solution("nivellement par le solvant").