L'hémioxyde d'azote
Structure
C'est une molécule linéaire : \(\textrm N-\textrm N-\textrm O\)
Préparation
On l'élabore avec le nitrate d'ammonium, qui est un produit très courant (engrais) :
\(\textrm{NH}_4\textrm{NO}_3 \to \textrm N_2\textrm O+2.\textrm H_2\textrm O\textrm{ }\textrm{ }\textrm{à 250 °C}\)
Attention :
Chauffer le nitrate d'ammonium à des températures supérieures peut amener à des explosions très violentes.
\(\textrm N_2\textrm O\) est un sous-produit important de la synthèse d'acide nitrique. En effet, il s'en fabrique spontanément au cours du procédé d'Ostwald (oxydation de l'ammoniac), avec un faible rendement, mais les quantités traitées étant énormes, cela fait quand même beaucoup !
Propriétés
C'est un gaz à \(\textrm{25 °C}\). \(T_{eb}=-93 °\textrm C\) soit \(180 \textrm K\)
Il se décompose à \(\textrm{500 °C}\) en \(\textrm N_2+\frac{1}{2}.\textrm O_2\)
On l'utilisait comme anesthésique, car c'est le « gaz hilarant » qui provoque une euphorie du patient avec insensibilisation.
\(\textrm N_2\textrm O\) est un comburant (oxydant) intéressant, car non-explosif, pas cher, et facile à manipuler et stocker.
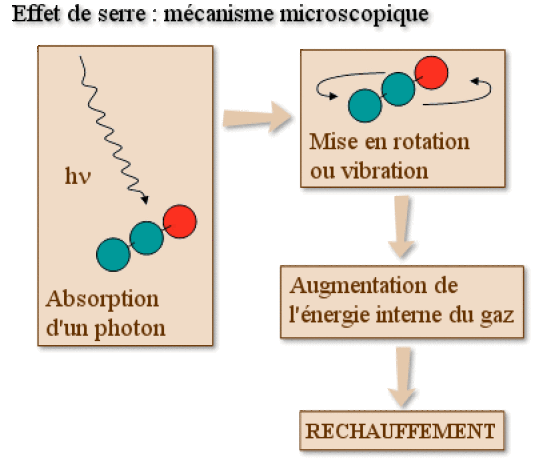
\(\textrm N_2\textrm O\) fait partie des gaz à effet de serre (\(\textrm{CH}_4\), \(\textrm{CO}_2\), \(\textrm{CFCs}\), \(\textrm{SF}_6\)) : présents dans la haute atmosphère, ils sont capables de transformer une partie du rayonnement infrarouge issu de la surface terrestre en chaleur. En effet, il existe des fréquences de rayonnement infrarouge qui coïncident exactement avec des fréquences de vibration et / ou de rotation de cette molécule : celles-ci sont absorbées et transformées en énergie de vibration / rotation, qui vient s'ajouter à celle de translation pour constituer l'énergie thermique : la température s'élève donc.