Les NOx
Comme on l'a vu pour chaque espèce, de nombreuses réactions entre oxygène et dérivés oxygénés de l'azote ont lieu, ce qui fait que l'on est toujours en présence d'un mélange contenant, en proportions variables :
\(\textrm N_2\textrm O\), \(\textrm{NO}\), \(\textrm N_2\textrm O_3\), \(\textrm{NO}_2\), \(\textrm N_2\textrm O_4\)
Les échanges avec les solutions aqueuses sont assez complexes, car les degrés impairs (III et V) sont majoritaires en solution aqueuse alors que les degrés pairs (II et IV) sont en quantité notable en phase gazeuse.
Ainsi, au-dessus d'une solution concentrée d'acide nitrique (degré V), on peut voir des vapeurs rousses de \(\textrm{NO}_2\) (degré IV).
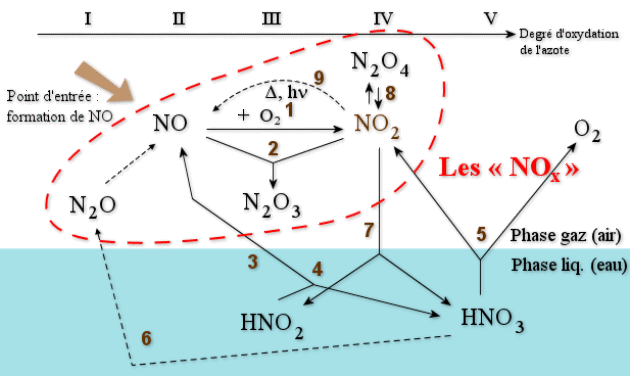
Un schéma illustrant le cycle des \(\textrm{NO}_\textrm x\) est reporté ci-dessous. Les numéros associés aux flèches correspondent aux réactions suivantes :
oxydation spontanée de \(\textrm{NO}\).
médiamutation spontanée.
hydrolyse du sesquioxyde d'azote.
décomposition spontanée de l'acide nitreux.
décomposition (lente) de l'acide nitrique (en \(\textrm{NO}_2 \textrm{(g)}+\textrm O_2\)).
dénitrification industrielle de l'acide nitrique (en \(\textrm{N}_2\textrm O \textrm{(g)}\)).
décomposition spontanée du dioxyde d'azote dans l'eau.
dimérisation réversible du dioxyde d'azote.
décomposition du dioxyde d'azote sous l'effet de la chaleur ou du rayonnement UV.
décomposition de l'hémioxyde sous l'effet des rayonnements UV.