L'anhydride nitrique et l'acide nitrique
Structure
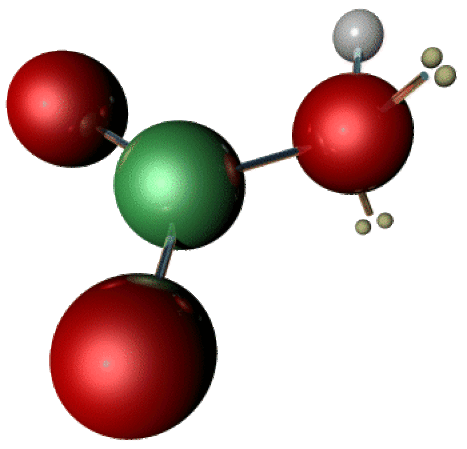
\(\textrm{HNO}_3\) est une molécule plane ressemblant à \(\textrm H_2\textrm{CO}_3\) .Les liaisons \(\textrm N-\textrm O\) sont d'un ordre légèrement supérieur à 1, ce qui explique sa planéité.
\(\textrm N_2\textrm O_5\) est un solide ionique formé d'ions nitrate (\(\textrm{NO}_3^-\)) et nitryle (\(\textrm{NO}^+_2\)).
Préparation
Il y a deux procédés industriels. Le premier est une hydrolyse des nitrates naturels (provenant surtout du Chili) par l'acide sulfurique :
\(\textrm H_2\textrm{SO}_4 \textrm{(l)}+\textrm{NaNO}_3 \textrm{(s)}\leftrightarrow \textrm{NaHSO}_4 \textrm{(s)}+\textrm{HNO}_4 \textrm{(g)}\) (à \(150 °\textrm C\))
C'est le fait que \(\textrm{HNO}_3\) soit plus volatil que les autres composés qui permet d'utiliser cette réaction à l'échelle industrielle.
Le second provient de l'oxydation catalytique de \(\textrm{NH}_3\), suivi de l'hydrolyse de \(\textrm{NO}_2\).
Rappel : Oxydation de l'ammoniac
Il y a deux réactions principales d'oxydation en voie sèche :
\(\mathrm{NH_3+\frac{3}{4}O_2\Leftrightarrow\frac{1}{2}N_2+\frac{3}{2}H_2O}~~~\Delta~H°_{298K}=-300~\mathrm{kJ.mol}^{-1}\)
\(\mathrm{NH_3+\frac{5}{4}O_2\Leftrightarrow\mathrm{NO+\frac{3}{2}H_2O}}~~~\Delta~H°_{298K}=-214~\mathrm{kJ.mol}^{-1}\)
La première est favorisée au détriment de la seconde, mais elle n'a aucun intérêt.
\(\textrm{NO}\) est directement oxydable à froid par le dioxygène :
\(\textrm{NO (g)}+\frac{1}{2}.\textrm{O}_2 \textrm{(g)}\to\textrm{NO}_2 \textrm{(g)}\) (complète pour \(T<150 °\textrm C\))
Rappel : Hydrolyse du dioxyde d'azote
L'hydrolyse de \(\textrm{NO}_2\) amène à la formation d'acide nitrique, c'est une étape-clé du cycle industriel de l'azote. Plusieurs réactions ont lieu en même temps :
\(2.\textrm{NO}_2+\textrm H_2\textrm O\leftrightarrow\textrm{HNO}_2+\textrm{HNO}_3\) (hydrolyse de \(\textrm{NO}_2\))
\(3.\textrm{HNO}_2\leftrightarrow\textrm{HNO}_3+2.\textrm{NO}+\textrm H_2\textrm O\) (dismutation de \(\textrm{HNO}_2\))
\(\textrm{NO}+\frac{1}{2}.\textrm O_2\leftrightarrow \textrm{NO}_2\) (oxydation de \(\textrm{NO}\))
\(\textrm N_2\textrm O_5\) est préparé à partir de l'acide nitrique par déshydratation, en utilisant un agent classique : l'anhydride phosphorique.
Propriétés de l'acide nitrique
Il est liquide à température ambiante (\(T_{eb}=86 °\textrm C\) soit \(359 \textrm K\))
Il est très soluble dans l'eau, avec une ionisation totale : c'est un acide fort, qui donne l'ion nitrate en solution :
\(\textrm{HNO}_3+\textrm H_2\textrm O\leftrightarrow\textrm H_3\textrm O^++\textrm{NO}^-_3\)
L'importance des interactions entre les molécules d'eau et l'acide nitrique se mesure au fait qu'il existe un azéotrope (\(68\%~\textrm{mol.HNO}_3\), \(32\%~\textrm H_2\textrm O\)), qui bout seulement à \(22 °\textrm C\) soit \(395 \textrm K\).
L'ion nitrate est un oxydant fort en milieu aqueux :
\(\textrm{NO}_3^-+2.\textrm H_3\textrm O^++\textrm e^-\to \textrm{NO}_2 \textrm{(g)}+3.\textrm H_2\textrm O\textrm{ }\textrm{ }E°=+0\textrm,79 \textrm{V/e.n.h.}\)
\(\textrm{NO}_3^-+4.\textrm H_3\textrm O^++3.\textrm e^-\to \textrm{NO} \textrm{(g)}+6.\textrm H_2\textrm O\textrm{ }\textrm{ }E°=+0\textrm,96 \textrm{V/e.n.h.}\)
Tous les métaux dont les potentiels d'oxydation sont inférieures à \(0\textrm,96 \textrm V\) peuvent donc être attaqués par l'acide nitrique. Les dégagements de \(\textrm{NO}_\textrm x\) dus à l'oxydation justifient l'appellation d'acide nitrique « fumant » pour les solutions concentrées.
L'or (\(1\textrm,38 \textrm V\)) et le platine (\(1\textrm,20 \textrm V\)) ne sont pas attaqués. Par contre, si l'on combine \(\textrm{HCl}\) et \(\textrm{HNO}_3\) (eau régale), il apparaît un couple encore plus oxydant :
\(3.\textrm{Cl}^-+\textrm{NO}_3^-+4.\textrm H_3\textrm O^+\to\textrm{NOCl}+\textrm{Cl}_2 \textrm{(g)}+2.\textrm H_2\textrm O\textrm{ }\textrm{ }E°_{\textrm{(Cl}^-\textrm{/Cl}_2\textrm)}=1\textrm,36 \textrm V\)
et de plus \(\textrm{Cl}^-\), agit comme complexant sur l'or :
\(\textrm{Au (s)}+4.\textrm{Cl}^-\to\textrm{AuCl}^-_4+3.\textrm e^-\textrm{ }\textrm{ }E°=0\textrm,98 \textrm V\)
Par ailleurs, l'acide nitrique est un composé très important pour la préparation de dérivés organonitrés, parmi lesquels des explosifs bien connus comme la TNT (trinitroglycérine).