Le monoxyde d'azote
Structure
C'est une molécule diatomique, dont voici le diagramme d'Orbitales Moléculaires :
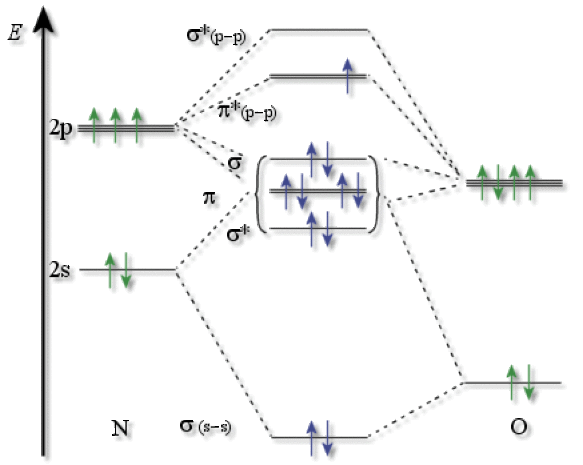
On voit, à partir du diagramme d'orbitales moléculaires qu'il y a un électron antiliant isolé sur l'OMHO (Orbitale Moléculaire la plus Haute Occupée), ce qui explique le caractère paramagnétique de cette molécule.
Préparation
On l'obtient par oxydation de l'ammoniac :
\(\mathrm{NH_3(g)+\frac{5}{4}O_2(g)\to~NO(g)+\frac{3}{2}H_2O}~~~\Delta~H°_{298K}=-214\mathrm{kJ.mol^-1}\)
Il existe une réaction parasite :
\(\mathrm{NH_3+\frac{3}{4}O_2\Leftrightarrow\frac{1}{2}N_2+\frac{3}{2}H_2O}~~~\Delta~H_{298K}=-300\mathrm{kJ.mol^{-1}}\)
Mais le recours à un catalyseur spécifique (procédé d'Ostwald) permet de rendre la réaction intéressante plus rapide que cette dernière.
Propriétés
C'est un gaz à \(\textrm{25 °C}\). Sa température d'ébullition est \(T_{eb}=-148 °\textrm C\) soit \(125 \textrm K\).
C'est une base de Lewis, ce qui en fait un ligand classique des métaux de transition. Par exemple, il déplace l'ion cyanure \(\textrm{CN}^-\) autour du fer :
\(\textrm{[Fe}^\textrm{II}\textrm{(CN)}_6\textrm]^{4-}+\textrm{NO}\to\textrm{[Fe}^\textrm{II}\textrm{(CN)}_5\textrm{(NO}\textrm{)]}^{3-}+\textrm{CN}^-\)
Il cède facilement son électron antiliant, ce qui en fait un réducteur (bien que ce soit un oxyde !!). Par exemple, il réduit le fer III :
\(\textrm{[Fe}^\textrm{III}\textrm{(CN)}_6\textrm]^{3-}+\textrm{NO}\to\textrm{[Fe}^\textrm{II}\textrm{(CN)}_5\textrm{(NO}^+\textrm{)]}^{2-}+\textrm{CN}^-\)
L'ion nitrosyle \(\textrm{NO}^+\) produit est un autre ligand classique des métaux de transition.
Autre exemple : il réagit avec le dichlore :
\(\textrm{NO}+\frac{1}{2}.\textrm{Cl}_2\to\textrm{NOCl}\)
Cette réaction peut être vue soit comme une réaction d'oxydo-réduction (oxydation de \(\textrm{NO}\) par \(\textrm{Cl}_2\)), soit comme une réaction d'addition électrophile du dichlore sur \(\textrm{NO}\)).
Enfin, \(\textrm{NO}\) est directement oxydable à froid par le dioxygène :
\(\textrm{NO (g)}+\frac{1}{2}.\textrm O_2 \textrm{(g)}\to\textrm{NO}_2 \textrm{(g)} \textrm{(complète pour } T<150 °\textrm{C)}\)
Pollution par NOx
Centre Interprofessionnel Technique d’Études de la Pollution Atmosphérique ( www.citepa.org)
\(\textrm{NO}\) a trois effets perturbateurs sur l'environnement :
Il provoque une eutrophisation (augmentation de la croissance des plantes), car les plantes l'assimilent facilement.
Il réagit avec l'ozone pour former du dioxygène : ceci permet de limiter la concentration en « mauvais » ozone au cœur des zones industrielles (effet plutôt bénéfique), mais par contre il contribue à attaquer le « bon » ozone stratosphérique (diminution de la protection contre les UV durs interstellaires).
Complément : L'Ozone
L'ozone \(\textrm O_3\) est une molécule triatomique moins stable que le dioxygène ; elle a une forme coudée.
Elle est décomposée par les UV mais elle se recycle naturellement dans la haute atmosphère. C'est ce qui fait que la couche d'ozone stratosphérique nous protège des UV.
Il provoque des pluies acides, car la réaction de \(\textrm{NO}_2\) avec l'eau atmosphérique amène à la formation d'acide nitreux \(\textrm{HNO}_2\) et nitrique \(\textrm{HNO}_3\):
\(\textrm{NO (g)}+\frac{1}{2}.\textrm O_2 \textrm{(g)}\to \textrm{NO}_2 \textrm{(g)}\)
\(2.\textrm{NO}_2+\textrm H_2\textrm O\to \textrm{HNO}_2+\textrm{HNO}_3\)
Elimination de NO
Dans l'industrie, on procède à une réduction sélective par l'ammoniac sur catalyseur métallique :
\(\textrm{NO}+\textrm{NH}_3\to\textrm N_2+\textrm H_2\textrm O\)
ou en choisissant une température optimum de conversion, sans catalyseur, entre 870 et \(980 °\textrm C\). Au-dessus, l'oxydation de \(\textrm{NH}_3\) prend le dessus.
Rappel : Oxydation de NH3 en voie sèche
Il y a deux réactions principales d'oxydation en voie sèche :
\(\mathrm{NH_3+\frac{3}{4}O_2\Leftrightarrow\frac{1}{2}N_2+\frac{3}{2}H_2O~~~ \Delta~H°_{298K}=-300~\mathrm{kJ.mol^{-1}}}\)
\(\mathrm{NH_3+\frac{5}{4}O_2\Leftrightarrow~NO+\frac{3}{2}H_2O~~~ \Delta~H°_{298K}=-214~\mathrm{kJ.mol^{-1}}}\)\(\)
Dans les pots catalytiques, on utilise un catalyseur au rhodium qui permet de promouvoir la réaction :
\(\textrm{NO}\to\frac{1}{2}.\textrm N_2+\frac{1}{2}.\textrm O_2\)
Celui-ci, par contre, n'a aucune efficacité pour détruire le monoxyde de carbone, donc on l'utilise en conjonction avec du platine.