Structure et propriétés physiques de la molécule d'eau
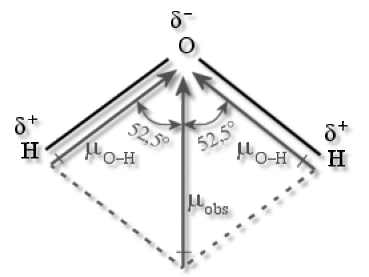
La molécule \(\textrm H_2\textrm O\) est angulaire ; elle comporte deux liaisons covalentes \(\textrm O-\textrm H\) et deux doublets non appariés sur l'atome d'oxygène. La longueur de la liaison est de 96 pm et l'angle entre les deux liaisons est de 105° du fait de la répulsion exercée par les doublets liants sur les doublets non-liants. La présence de doublets non-liants sur l'atome d'oxygène ajoutée à la polarisation de la liaison \(\textrm O-\textrm H\) (due à la différence d'électronégativité), et à la géométrie de la molécule, confère à la molécule d'eau un moment dipolaire élevé : \(\mu=1\textrm,84\textrm{ }\textrm{Debye}\). La molécule d'eau présente donc une constante diélectrique relative élevée (\(\epsilon_r=80\)) ce qui explique le caractère ionisant de l'eau liquide.
Définition : Constante diélectrique élevée
La force électrostatique entre deux charges est donnée par la relation :
\(f_{\textrm{él}}=\frac{qq'}{4\pi\epsilon_0\epsilon_r}\times\frac{1}{r^2}\)
On en déduit que lorsque la constante diélectrique relative augmente, la force électrostatique entre les charges diminue. Cela revient à dire que les molécules d'eau isolent les charges les unes des autres.
Définition : Caractère ionisant de l'eau liquide
L'eau ayant tendance à diminuer les interactions entre charges, celles-ci peuvent donc exister séparément les unes des autres en milieu aqueux : l'eau est donc un bon solvant ionique, capable de dissoudre de nombreuses espèces chargées.
De plus, chaque atome d'oxygène appartenant à une molécule d'eau exerce une interaction électrostatique sur les atomes d'hydrogène appartenant à une autre molécule d'eau (interaction entre \(\textrm O^{\delta-}\) et \(\textrm H^{\delta+}\) ). La formation de ce type de liaisons (liaison hydrogène) a pour conséquence la formation d'entités tétraédriques (de façon fugace à l'état liquide et permanente à l'état solide). A l'état solide (et aux conditions ordinaires de pression) , la structure est peu dense et sa fusion entraîne une augmentation de la compacité. La masse volumique de l'eau liquide est supérieure à celle de la glace, ce qui explique que les icebergs flottent sur la mer.
