L'eau, base de Lewis
Du fait de l'existence de doublets électroniques non appariés sur l'atome d'oxygène, l'eau est susceptible de ce comporter comme une base de Lewis (donneur de doublet) vis à vis d'entités susceptibles de l'accepter. Ceci explique en particulier ses propriétés acido-basiques au sens de Brønsted :

Ainsi, en présence d'ions \(\textrm M^{n+}\) en solution, l'eau peut avoir deux comportements types :
En présence d'ions gros et peu chargés (ou ne comportant pas d'orbitale vacante), une simple interaction électrostatique de type ion (\(\textrm M^{n+}\)) / dipôle (\(\textrm H_2\textrm O\)) peut apparaître.
C'est en fait une solvatation.
\((\textrm M^{n+})+p.\textrm{H}_2\textrm O\leftrightarrow\textrm{M(H}_2\textrm{O)}^{n+}_p\)
C'est en particulier le cas des alcalins (\(\textrm{Li}^+\), \(\textrm{Na}^+\), \(\textrm K^+\), \(\textrm{Rb}^+\), \(\textrm{Cs}^+\)) et de l'ammonium (\(\textrm{NH}_4^+\)) qui leur est très semblable.
Dans le cas des cations petits et chargés (acide de Lewis forts), la molécule d'eau joue le rôle de ligand (base de Lewis). Il y a alors formation d'ions complexes de géométrie définie par le nombre de ligands \(\textrm H_2\textrm O\) fixés sur le cation central : généralement 2, 4 ou 6 conduisant à des complexes linéaires, tétraédriques ou plans carrés et octaédriques.
Exemple :
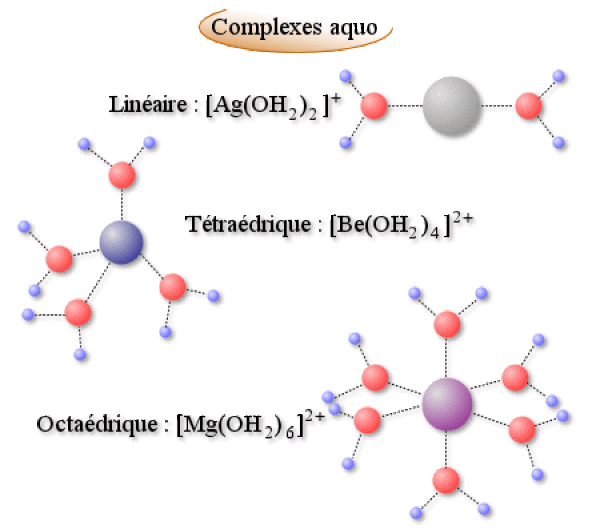
\(\textrm H_2\textrm O\) est cependant un ligand de force moyenne et pourra aisément être substitué par des ligands plus forts tels \(\textrm{NH}_3\), \(\textrm{NO}^-_2\), \(\textrm{CN}^-\), etc.
De tels complexes existent également à l'état solide et sont appelés hydrates. La détermination de la structure des hydrates permet de connaître la géométrie des entités formées. Par exemple, \(\textrm{MgSO}_4\textrm,7.\textrm H_2\textrm O\) (sel d'Epsom) est formé d'entités octaédriques \([\textrm{Mg}(\textrm H_2\textrm O)_6]^{2+}\), \(\textrm{SO}_4^{2-}\) et \(\textrm H_2\textrm O\). Du fait de la faible énergie de liaison des molécules d'eau (non ligand) à l'édifice, celles-ci disparaissent rapidement lors d'une élévation de température (\(T\approx45 °\textrm C\)). En revanche, lorsque les molécules d'eau sont liées aux cations (eau de constitution), la dissociation de l'hexahydrite \(\textrm{MgSO}_4\textrm,6.\textrm H_2\textrm O\) n'a lieu qu'à température plus élevée (\(T\approx70 °\textrm C\)).