L'eau, acide faible et base faible de Brønsted
L'eau à l'état liquide est un composé amphotère à la fois acide et base au sens de Brønsted (susceptible de capter et de perdre un \(\textrm H^+\)). Il lui correspond les deux couples acido-basiques : \(\textrm H_3\textrm O^+/\textrm H_2\textrm O\) et \(\textrm H_2\textrm O/\textrm{OH}^-\).
L'eau : acide faible
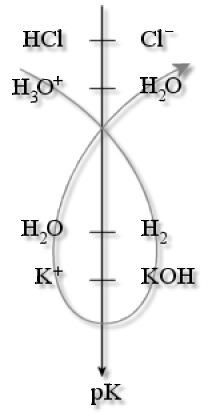
L'eau est un acide faible (couple : \(\textrm H_2\textrm O/\textrm{OH}^-\)) dont la constante d'acidité est \(K_A=10^{-14}\). Cet acide faible n'a quasiment pas d'action sur les bases très faibles (telle que les chlorures \(\textrm{Cl}^-\) ) mais présente une action non négligeable sur les bases moyennement faibles (telle que les ions acétate \(\textrm{CH}_3\textrm{COO}^-\)). En revanche, la réaction de l'eau est quasi-totale avec les bases fortes (telles que la potasse \(\textrm{KOH}\) ou la soude \(\textrm{NaOH}\)) :
\(\textrm{KOH}\stackrel{\textrm H_2\textrm O}{\longrightarrow}\textrm K^+ \textrm{(aq)}+\textrm{OH}^- \textrm{(aq)}\)
Le \(\textrm{pH}\) de la solution obtenue sera alors basique. \(\textrm{KOH}\) est nivelé sur \(\textrm{OH}^- \textrm{(aq)}\), car \(\textrm{OH}^- \textrm{(aq)}\) est la base la plus forte qui puisse exister dans l'eau : toute base plus forte que cet ion est détruite.
L'eau : base faible
De manière analogue, l'eau est une base faible (couple \(\textrm H_3\textrm O^+/\textrm H_2\textrm O\)) dont la constante d'acidité à \(25 °\textrm C\) vaut \(K_A=0\) (par convention). L'eau n'a quasiment pas d'action sur les acides très faibles (comme \(\textrm C_2\textrm H_5\textrm{OH}\)) mais présente une réaction d'hydrolyse non négligeable avec les acides faibles ou moyennement forts (tel que l'ion ammonium \(\textrm{NH}_4^+\)) :
\(\textrm{NH}^+_4+\textrm H_2\textrm O\to\textrm{NH}_3 \textrm{(aq)}+\textrm H_3\textrm O^+ \textrm{(aq)}\)
Le \(\textrm{pH}\) de la solution obtenue sera alors acide (inférieur à 7).
La réaction est quasi-totale avec les acides forts (tel que l'acide chlorhydrique \(\textrm{HCl}\)) :
\(\textrm{HCl}+\textrm H_2\textrm O\stackrel{\textrm H_2\textrm O}{\longrightarrow}\textrm{Cl}^- \textrm{(aq)}+\textrm H_3\textrm O^+ \textrm{(aq)}\)
Le \(\textrm{pH}\) de la solution obtenue sera alors très faible car \(\textrm{HCl}\) est nivelé par \(\textrm H_3\textrm O^+ \textrm{(aq)}\), qui est l'acide le plus fort qui puisse exister dans l'eau.
Règle : Règle de gamma