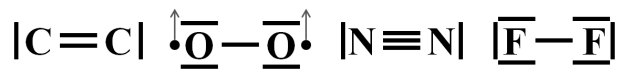Orbitales Atomiques / Orbitales Moléculaires
Partie
Ce TP consiste à construire les diagrammes d'énergie des orbitales atomiques de différents atomes de la fin de la 2ème période du tableau périodique et les diagrammes des orbitales moléculaires des molécules diatomiques correspondantes.
A partir de ces diagrammes, il est possible de déduire des propriétés comme l'énergie d'ionisation d'un atome ou l'ordre de liaison entre deux atomes au sein d'une molécule.
Une Orbitale Atomique (OA) est une fonction mathématique, solution de l'équation de Schrödinger, décrivant le comportement ondulatoire d'un électron autour d'un noyau isolé.
Une Orbitale Moléculaire (OM) est une fonction mathématique, solution de l'équation de Schrödinger, décrivant le comportement ondulatoire d'un électron dans une molécule. Elle résulte de la combinaison des OA de chaque atome constituant la molécule.
Question
1. Construisez le diagramme d'énergie des orbitales atomiques du carbone. Pour cela, effectuez un calcul d'énergie sur un atome de carbone en utilisant les paramètres suivants :
• UHF
• Multiplicité de spin : 3
• Base STO3G
2. Identifiez les OA de cœur et de valence sur le diagramme et commentez les différences d'énergie observées entre chacune d'entre elles.
Solution détaillée
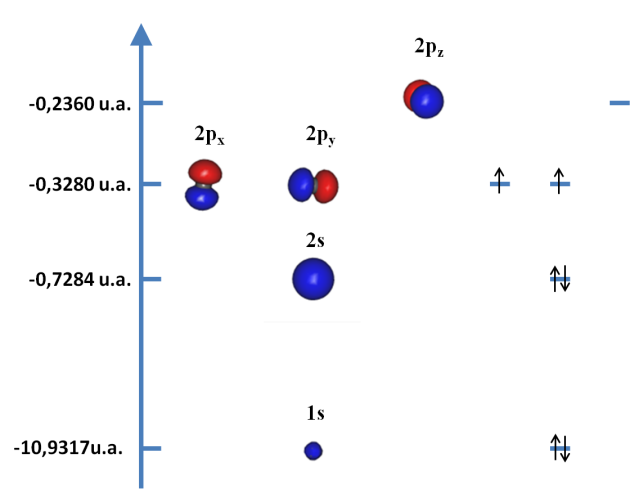
1. A partir des résultats obtenus lors du calcul, on reconstruit le diagramme suivant.
Figure 1 : diagrammes des OA de l'atome de carbone. L'atome de carbone est en gris. Les énergies de chaque orbitale sont reportées sur l'axe à gauche de la figure. Les OA apparaissent au centre de la figure et leur occupation sur la droite. Il existe une différence d'énergie entre les OA occupées px py et l'OA pz vacante.
Rappel :
Les orbitales de valence sont les orbitales dont le nombre quantique principale, n, est le plus grand.
2. Ce diagramme montre l'important écart d'énergie entre les orbitales de cœur, 1s, et les orbitales de valence 2s et 2p qui au contraire sont plus proches en énergie. Les trois orbitales de plus haute énergie, les OA 2p, forment les OA les plus Hautes Occupées (HO).
Question
L'énergie d'ionisation est une grandeur positive exprimant l'énergie nécessaire à fournir à un atome pour lui arracher un électron. L'énergie de première ionisation est associée à la réaction suivante :
Atome -> Atome+ + e-
Avant d'obtenir le prix Nobel d'économie d'économie en 1975, le néerlandais Tjalling Koopmans avait démontré que l'énergie d'ionisation d'un atome est égale à l'inverse de l'énergie de l'orbitale occupée la plus haute (HO). Ce théorème est valide dans l'approximation de Hartree Fock, en considérant que les orbitales atomiques des ions sont identiques à celles de l'atome neutre.
En vous basant sur le théorème de Koopmans, calculez les énergies de première ionisation des atomes de carbone, azote, oxygène et fluor (Pensez à noter les énergies des OA alpha et beta). La base employée donne des OA non occupées supplémentaires, il est important de ne s'intéresser uniquement à l'OA HO.
a. Quelle est la multiplicité de spin des différents atomes étudiés ?
b. Effectuez des calculs d'énergie en utilisant les paramètres suivants :
• Symétrie de type C1
• UHF
• Base 6-31G
Pour convertir une énergie obtenue en u.a. en e.v. (électron volt), il faut la multiplier par 27,211.
Solution détaillée
Les atomes possèdent les multiplicités de spin suivantes :
• Oxygène : 3
• Azote : 4
• Fluor : 2
Les orbitales 2p forment les OA HO pour l'atome de carbone. Leur énergie est de -12,91 ev.
Pour l'atome d'azote, l'OA HO est constituée par les OA 2p. Celles-ci ont une énergie de -15,44 ev.
Pour l'atome d'oxygène, l'OA HO est constituée par l'OA 2pz (beta). Celle-ci a une énergie de -13,88 ev.
Pour l'atome de fluor, les OA 2pz(\(\beta\)) ou 2py(\(\beta\)) forment les OA HO. Leur énergie est de -18,04 ev.
Ces valeurs permettent d'établir le graphique suivant, montrant l'évolution de l'énergie d'ionisation en fonction des atomes constituant la deuxième ligne du tableau périodique.

Figure 2 : énergie d'ionisation des atomes de carbone, azote, oxygène et fluor.
Le caractère non linéaire du graphique s'explique par le remplissage de la couche de valence des atomes.
L'atome d'azote présente une couche à demie remplie qui est stabilisante. L'ionisation entraîne donc la formation d'une conformation moins stable. Au contraire, la perte d'un électron pour l'atome d'oxygène conduit à cette conformation stabilisée. Ainsi il nécessaire d'apporter plus d'énergie pour arracher un électron à un atome d'azote qu'à un atome d'oxygène.
Question
Pour illustrer la formation des Orbitales Moléculaires (OM) il vous est demandé de construire un diagramme des orbitales moléculaires de molécules simples : C2, O2, N2 et F2 à partir des OA.
Pour construire le diagramme d'orbitales moléculaires, effectuez les calculs d'énergie en utilisant les paramètres suivants :
• Symétrie C1
• rOHF pour O2 et F2 et RHF pour N2 et C2.
• Base STO-3G
a) Quels est la multiplicité de spin de chacune des molécules étudiées ?
b) Déduisez de ces diagrammes les ordres de liaisons de chacune des molécules.
Solution détaillée
La multiplicité de spin est de 1 pour la molécule C2, de 3 pour la molécule O2, de 1 pour la molécule N2 d'azote et de 1 pour la molécule F2.
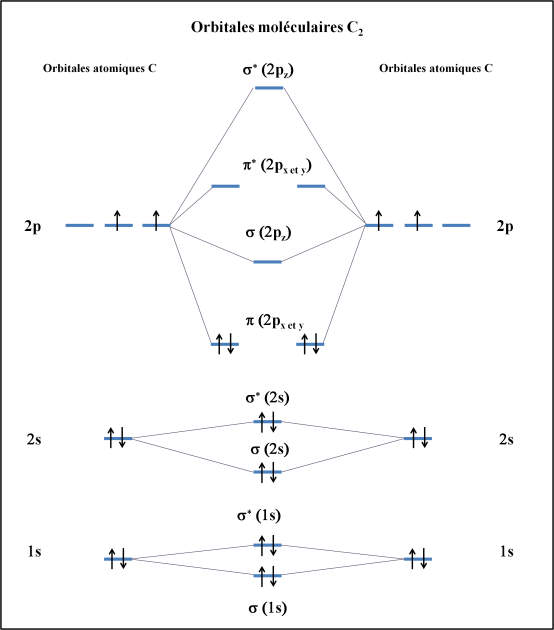
Les OM sont issues des interactions des OA selon :
Figure 3 : construction du diagramme d'orbitales moléculaires de C2. Les orbitales atomiques des deux atomes de carbone apparaissent sur la droite et la gauche de la figure. Leur interaction donne lieux aux orbitales moléculaires qui apparaissent au centre de la figure. Les orbitales moléculaires antiliantes possèdent un astérisque en exposant.
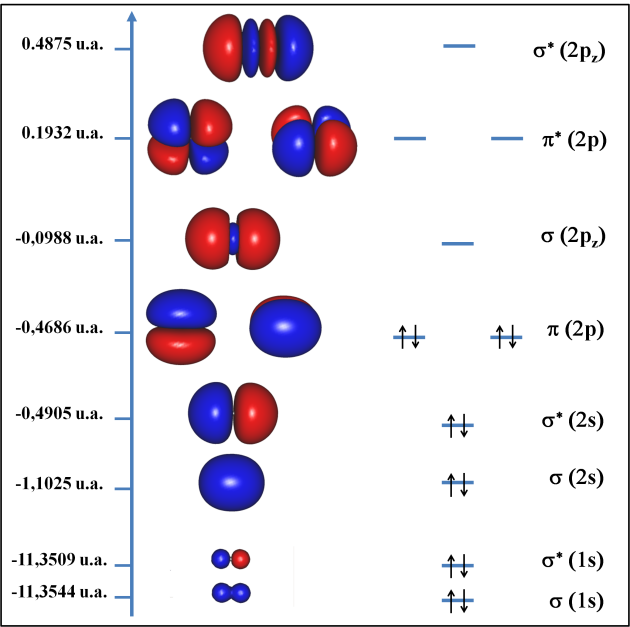
Pour la molécule C2, les résultats permettent de construire le diagramme d'orbitales moléculaires suivant.
Figure 4 : diagramme des OM de la molécule C2.
Ce diagramme fait clairement apparaître l'importante différence d'énergie entre les orbitales \(\sigma\)(1s) et les autres. L'orbitale occupée la plus haute est l'orbitale \(\alpha\) (2p) et la plus basse vacante est \(\sigma\)(2pz).
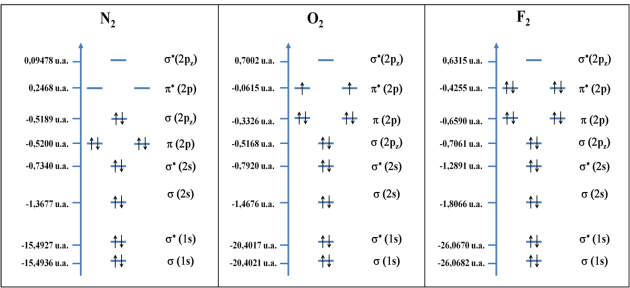
Pour les autres molécules les calculs effectués permettent de construire les diagrammes suivants :
Figure5 : comparaison des diagrammes d'OM des molécules N2, O2 et F2.
La comparaison de ces diagrammes met en évidence l'inversion des orbitales \(\pi\)(2p) et \(\sigma\)(2pz) dans le cas des molécules de O2 et F2.
Rappel :
La propriété paramagnétique de O2 a été découverte par Michael Faraday au cours des années 1840. Par suite, c'est le prix Nobel de chimie Robert Mulliken qui a démontré, par des calculs de chimie théorique, que cette propriété provenait de la présence d'électrons célibataires dans la molécule.
Le diagramme d'orbitales moléculaires de la molécule de O2 met en évidence la présence d'électrons célibataires sur les orbitales \(\pi\)*(2px et y) ayant des spins parallèles. Cette conformation induit un caractère paramagnétique à la molécule.
Rappel :
L'ordre de liaison (OL) des molécules est la demi différence entre le nombre d'électrons liants et le nombre d'électrons antiliants :
OL = (ne- l – ne- al)/2
On en déduit alors l'ordre de liaison de chacune des molécules :
• C2 : 2
• N2 : 3
• O2 : 2
• F2 : 1
On peut en déduire la conformation de Lewis des molécules.
Figure 7 : représentation de Lewis des différentes molécules étudiées.