Comparaison entre les approches de type VSEPR et les calculs de chimie quantique
Partie
Ce TP vise à comparer les géométries obtenues au moyen des méthodes VSEPR et de chimie quantique.
Cette méthode a été développée en 1957 par le chimiste canadien Ronald J. Gillepsie. VSEPR est l'acronyme de Valence Shell Electron Pair Repulsion. Elle permet de prévoir la géométrie d'une molécule de type AXnEp (figure 1) en connaissant la répartition des paires électroniques de valence autour de l'atome central.
Figure 1 : schématisation d'une molécule
A. Principes de base
Cette théorie est basée sur l'approximation des paires d'électrons à des charges ponctuelles. Les doublets électroniques de la couche de valence sont tous situés sur une sphère centrée sur le noyau de l'atome. Ces doublets électroniques sont soumis à une force de répulsion électrostatique, qui induit leur répartition. La géométrie la plus stable d'une molécule correspondra alors à une répartition des doublets pour laquelle leurs distances sont maximales. La théorie VSEPR permet donc de prévoir la géométrie d'une molécule mais aussi la position des doublets non liants.
B. Géométrie VSEPR
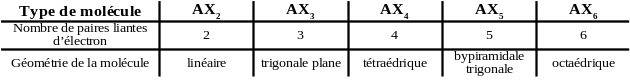
Le tableau suivant regroupe les géométries de la famille AXn.
Afin de comparer les deux méthodes nous allons nous intéresser à différentes molécules dérivants de la géométrie AX4.
Question
Construire les molécules de méthane, d'ammoniac, d'eau et d'acide éthanoïque à l'aide de l'éditeur gabedit.
1. Déterminer le type et la géométrie de chacune de ces molécules.
Effectuer alors un calcul d'optimisation de géométrie avec la base 6-31G pour les différentes molécules.
Solution détaillée
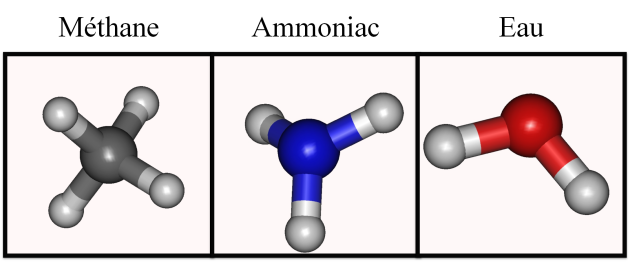
La molécule de méthane est de type AX4 et sa géométrie est tétraédrique.
La molécule d'ammoniac est de type AX3E1 et sa géométrie est pyramidale.
La molécule d'eau est de type AX2E2 et sa géométrie est coudée.
Les structures optimisées de chacune de ces molécules sont présentées dans la figure 2.
Figure 2 : structure optimisée des molécules de la famille AX4
La molécule d'acide éthanoïque (figure 3) présente un carbone C1 de type AX4 (fragment CH3) et un autre, C2, de type AX3 (fragment COOH).
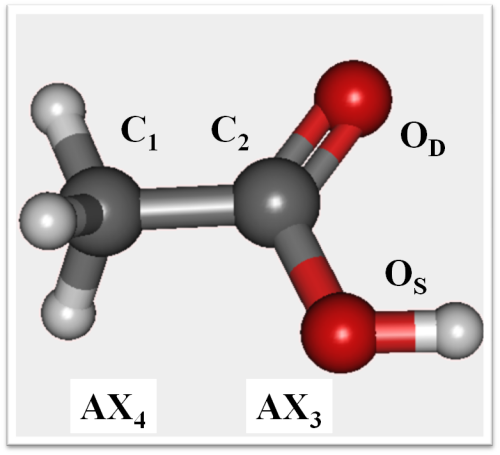
Figure 3 : structure optimisée de la molécule d'acide éthanoïque
Question
2. Sur les structures minimisées, mesurer les angles entre l'atome central et les atomes ligands. Comparer ces valeurs à celles provenant de la méthode VSEPR.
Solution détaillée
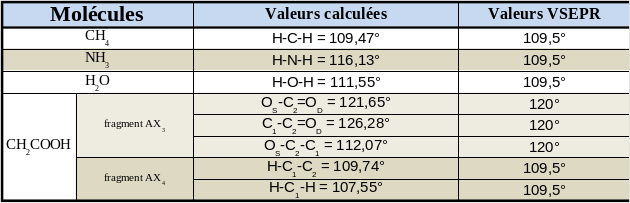
Les valeurs mesurées sont regroupées dans le tableau suivant.
Pour la molécule de méthane (de type AX4), la valeur calculée de l'angle entre l'atome central et les atomes périphériques est identique à celle prédite par la théorie VSEPR. Pour la molécule d'ammoniac (de type AX3E1) il existe un écart entre la valeur calculée et la valeur donnée par la théorie VSEPR. Enfin, pour la molécule d'eau (de type AX2E2), l'écart entre la valeur calculée et la valeur théorique peut être considéré comme négligeable.
Remarque :
On note qu'expérimentalement l'angle entre l'atome central et les atomes périphériques diminue conjointement à l'augmentation du nombre de doublets non-liants. Cette diminution provient de la caractéristique des doublets non liants à occuper un volume plus important que les doublets liants.
Pour la molécule d'acide éthanoïque, on note que le carbone de type AX3 présente des angles dont les valeurs sont conformes à celles attendues (de l'ordre de 120 °). Dans le cas du fragment de type AX4, ils existent de faibles écarts avec les valeurs obtenues sur la molécule de méthane.
Question
Sur les molécules précédemment minimisées, mesurer les distances entre l'atome central et les atomes d'hydrogène. En quoi les valeurs VSEPR différent-elles des valeurs de la chimie quantique ?
Solution détaillée
L'évolution de la distance entre un atome d'hydrogène et un atome de carbone, d'azote ou d'oxygène est reportée sur la figure 4.
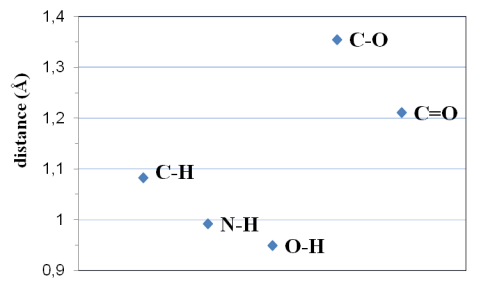
Figure 4 : évolution de la longueur des liaisons X-H et C-O
Il apparaît une nette diminution de la taille de la liaison X-H. Cette diminution de la longueur de liaison va de pair avec une augmentation de l'énergie de liaison. On note également une diminution de la longueur de liaison entre une liaison simple (C-O) et une liaison double (C=O).
Finalement les calculs de chimie quantique permettent d'obtenir une meilleure description géométrique des molécules là où le modèle VSEPR s'avère trop simpliste.
Question
Les calculs de chimie quantique permettent également de connaître la répartition des charges électroniques dans une molécule. Effectuer un calcul Single Point Energy (RHF, 6-31G) sur les structures optimisées des précédentes molécules (symmetry not used during calculation)
1. Relever les charges portées par les différents atomes de chacune des molécules. (menu render/label/show charges)
Solution détaillée
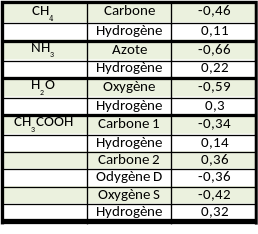
Les valeurs portées par chacun des atomes dans les différentes molécules sont présentées dans le tableau 2.
Question
2. Ces valeurs vous semblent-elles être en accord avec les caractéristiques chimiques des éléments ?
Solution détaillée
Le tableau 2 met en évidence que la valeur de la charge partielle d'un atome dépend de son environnement. Ces calculs donnent accès à la polarisation de chaque liaison étudiée, celle-ci étant dépendante de l'électronégativité (Cf. Définition) des atomes impliqués dans la liaison.
Pour l'atome d'hydrogène, plus l'atome avec lequel il est lié est électronégatif, plus sa charge partielle est importante. En comparant les molécules de méthane, d'ammoniac et d'eau, appartenant à la famille AX4, il devient possible de classer les liaisons X-H par pourcentage croissant de polarisation : O-H > N-H > C-H. On en déduit alors le classement des atomes en fonction de leur électronégativité : O > N > C > H.
Pour la molécule d'acide éthanoïque on observe que les deux carbones portent des charges partielles différentes selon qu'ils sont liés à des atomes d'hydrogène ou d'oxygène. Pour le fragment -CH3, le carbone porte une charge négative : il est plus électronégatif que les atomes d'hydrogène. Au contraire pour le fragment -COOH, le carbone porte une charge positive : il est moins électronégatif que les atomes d'oxygène.
Elle ne peut être mesurée et doit donc être calculée.
Définition :
L'électronégativité est une propriété chimique d'un atome (ou un groupe d'atome) d'attirer des électrons. Cette propriété a été pour la première fois exprimée par le prix Nobel Linus Pauling en 1932.
Question
Construire la molécule d'acide sulfurique (H2SO4) et (H3PO4). Minimiser la structure sous gabedit avec l'outil modélisation moléculaire (clic droit>molecular mechanics>optimization)
1. Effectuer alors un calcul d'optimisation de géométrie (base 6-31G, RHF et l'option « d heavy atom polarization function »). Effectuer ensuite un calcul de type Single Point Energy afin d'obtenir les charges partielles des différents atomes.
Solution détaillée
Après optimisation les structures présentent les charges partielles suivantes :
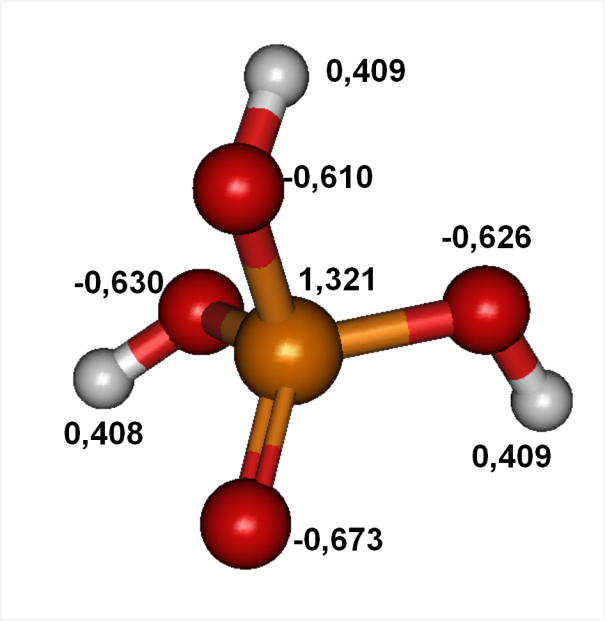
Figure 5 : charges partielles portées par la molécule d'acide phosphorique
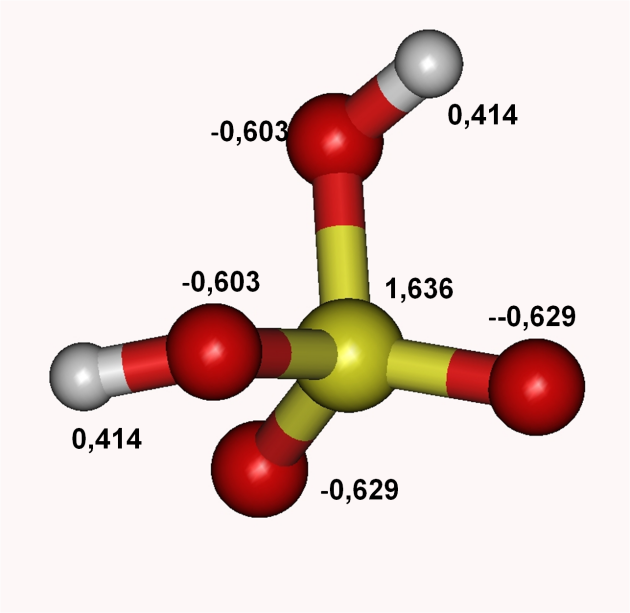
Figure 6 : charges partielles portées par la molécule d'acide sulfurique
Sur ces molécules, on remarque que les hydrogènes en liaison avec des oxygènes présentent des charges partielles positives. Ce résultat explique le caractère acide de ces composés qui sont alors capables de libérer des protons.
Conseil :
Finalement les calculs de chimie quantique permettent d'obtenir une meilleure description géométrique des molécules là où le modèle VSEPR s'avère trop simpliste. Notamment, ces calculs permettent de connaître les charges partielles des atomes constituants les molécules.