Effet inductif et effet mésomère
Partie
La réactivité d'une molécule est liée à sa structure et à ses propriétés électroniques. Un groupement chimique peut exercer des effets de natures différentes sur la répartition de la densité électronique d'une molécule. Il existe différents types d'effets électroniques comme les effets inductifs, mésomères, l'hyperconjugaison, etc. La chimie quantique permet de caractériser les propriétés électroniques des molécules et donc de mieux comprendre ces effets. Ce TP illustre ces concepts à travers l'étude des charges partielles dans différents systèmes moléculaires. On prédira l'évolution du pKa de différents acides et la réactivité d'un noyau benzénique substitué en vue d'une réaction de substitution électrophile aromatique.
1.Effet inductif
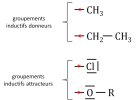
Lorsqu'une liaison est formée entre deux atomes de nature différente, il en résulte une polarisation de la liaison : les électrons sont attirés par l'atome le plus électronégatif. On définit alors le concept d'effet inductif qui peut être soit donneur (+I) soit accepteur (-I).
Dans le cas d'une liaison C-X, l'effet inductif accepteur résulte du déplacement des électrons de la liaison vers l'atome (ou groupement) X qui présente une électronégativité supérieure à l'atome de carbone. Au contraire un effet inductif donneur provient du déplacement des électrons de la liaison vers l'atome de carbone. Ces effets sont illustrés dans la figure 1.
2.Effet mésomère
La mésomérie désigne le fait que des électrons peuvent se délocaliser sur une ou plusieurs liaisons d'une molécule. Dans ce contexte, sa représentation de Lewis n'est plus unique mais résulte d'une combinaison de plusieurs structures dites mésomères. Seuls les électrons de type \(\pi\) sont concernés par cet effet, qui naît du recouvrement d'orbitales (généralement des orbitales p) avec des orbitales vacantes et/ou des doublets non liants.
Une molécule présentant plusieurs formes mésomères est stabilisée.
Par exemple le phénol (figure 2) est un système conjugué.
Figure 2 : molécule de phénol.
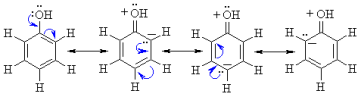
Il existe plusieurs formes mésomères du phénol qui sont regroupées dans la figure 3.
Figure 3 : formes mésomères du phénol.
Les différentes formes mésomères sont obtenues par des déplacements successifs de doublet d'électrons symbolisés par des flèches bleues.
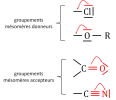
Selon la nature des atomes ou groupements d'atomes il résulte deux types d'effet mésomère : donneur (+M) et attracteur (-M). Les groupements attracteurs possèdent un atome fortement électronégatif lié par une liaison multiple, ils présentent ainsi la propriété d'accepter des doublets d'électrons. Au contraire, les groupements donneurs contiennent un atome fortement électronégatif lié par une simple liaison et possédant des doublets libres. La figure 4 illustre ces concepts de mésomères donneurs et accepteurs.
Figure 4 : exemples de groupements mésomères donneurs et accepteurs.
Question
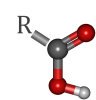
Afin d'étudier l'influence de l'effet inductif sur la force d'un acide, vous allez effectuer des calculs d'énergie sur une série d'acide carboxyliques (figure 5). Vous substituerez le groupement R par les groupements H, CH3, CH2CH3, F et CH2F. La force de l'acide ainsi construit sera déduite de la valeur de la charge partielle portée par l'atome d'hydrogène en liaison avec l'atome d'oxygène (cf figure 5).
Figure 5 : acide carboxylique étudié. La partie R est variable.
Construisez les différentes molécules. Optimisez leurs structures selon le protocole suivant :
- Clic droit Molecular mechanic>optimization
- Optimisation de géométrie RHF, base STO3G, symetry not used during calculation
Effectuez alors un calcul d'énergie (RHF, base 6-31G, symetry not used during calculation) pour obtenir les valeurs des charges partielles et regroupez les résultats sous forme d'un tableau.
Solution détaillée
Les valeurs des charges partielles de l'hydrogène sont regroupées dans le tableau 1.
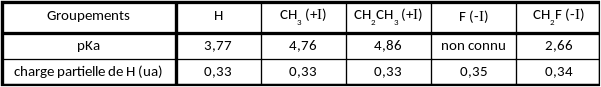
Tableau : valeur des charges partielles de l'atome d'hydrogène.
Il apparaît que la force de l'acide (valeur de pKa) évolue conjointement avec la valeur de la charge partielle portée par l'atome d'hydrogène. Cette grandeur constitue un descripteur pertinent de la force d'un acide.
Ces résultats mettent également en évidence qu'une augmentation de l'effet inductif donneur du groupement entraîne une diminution de la force de l'acide.
Question
Construisez la molécule de benzène et effectuez un calcul d'énergie (RHF, base STO3G).
Relevez alors les charges portées par les différents atomes.
Solution détaillée
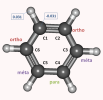
La figure 4 présente la molécule de benzène. Les charges partielles des atomes de carbone sont toutes égales à -0.031 e. Les charges partielles des atomes d'hydrogène sont toutes égales à 0.031 e. Sur cette figure apparaissent aussi le nom des positions ortho méta et para par rapport à l'atome C1.
Figure 4 : molécule de benzène. La numérotation des atomes de carbone sera conservée pour la suite de l'exercice.
Question
Sur la molécule de benzène remplacer l'atome d'hydrogène porté par l'atome C1 par les groupements suivants : -OH, -NO2, -COOH, -Cl, -OCH3, -CN
Optimiser la structure par une minimisation (clic droit> molecular mechanics > optimization) suivi d'un calcul d'optimisation de géométrie (RHF, base STO3G). Effectuez alors un calcul d'énergie afin d'obtenir les charges partielles des différents atomes de carbone. Relevez les charges portées par les différents atomes de carbone du cycle benzénique.
Solution détaillée
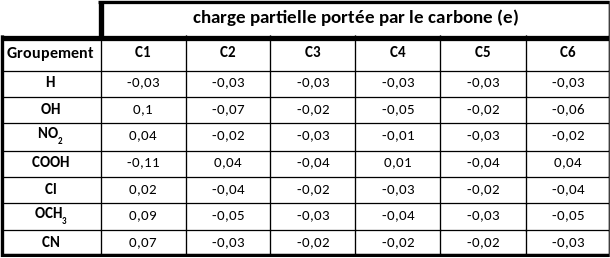
Tableau 2 : charge partielle portée par les carbones du cycle benzénique pour les différentes molécules étudiées.
Ce tableau souligne les différences de charges partielles induites sur les différents atomes de carbone. Suivant la nature du groupement, l'atome C1 présente des charges partielles positives ou négatives.
Question
Déterminez les effets induits par ces groupements et anticipez l'activation du cycle lors d'une substitution électrophile aromatique (SEA). Pour cela, calculez la variation de charge suite à une substitution de l'atome d'hydrogène porté par le carbone C1, en prenant comme référence le benzène. Vous retrancherez donc la première ligne du tableau à toutes les autres.
Solution détaillée
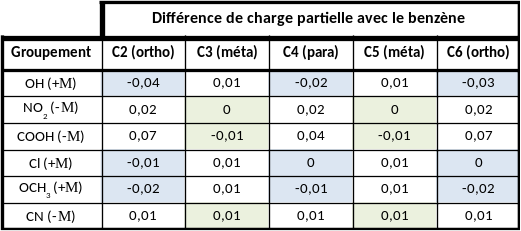
Tableau 3 : différence de charge partielle induite par l'introduction d'un groupement à la place de l'atome d'hydrogène porté par l'atome C1.
Sur ce tableau les atomes de carbone favorisés pour une réaction de substitution électrophile sont surlignés. Il est alors possible d'établir deux groupes de donneurs :
- ceux favorisants l'activation en positions ortho et para (OH, Cl et OCH3)
- ceux favorisant l'activation en positions méta (NO2, COOH et CN)
Le tableau 3 met en évidence que les groupements mésomères donneurs favorisent les positions ortho et para pour les réactions de substitution électrophile. La position méta est quant à elle favorisée par les groupements mésomères accepteurs.
Le chlore étant à la fois mésomère donneur et inductif accepteur il ne favorise que très faiblement les positions ortho et para.