Introduction
Après le travail préparatoire d'étude des différents spectres Broad Band, Off Resonance et DEPTque nous venons de faire, il y a lieu pour finir, d'écrire des structures candidates pour les spectres étudiés... Cela nécessite bien entendu une expérience qu'il convient d'acquérir entre autres en multipliant les exercices
de détermination des isochronies présentes dans une molécule,
d'attributions de signaux pour un composé donné,
de choix entre molécules candidates pour un spectre donné, ou encore
de choix entre spectres pour une molécule donnée.
Tous ces exercices vous sont offerts dans la partie "S'EXERCER".
Avant de se lancer dans l'écriture de structures, il convient de suivre la méthode préconisée dans l'analyse des spectres. Par exemple, pour le composé inconnu en \(\textrm C_7\textrm H_7\textrm N\), pour lequel nous venons de développer la problématique du comptage d'hydrogène et de la multiplicité associée, les étapes méthodologiques successives donnent :
isochronie : 7 Carbones, 7 pics dans le spectre BB donc pas d'isochronie. On peut tout de suite passer au compteur d'insaturation.
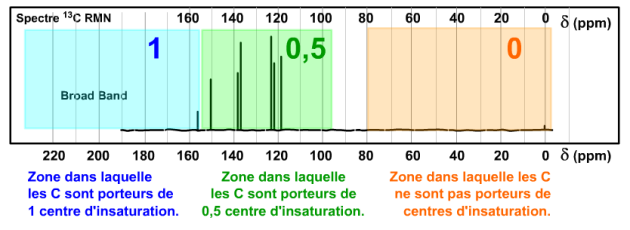
insaturation : composé en \(\textrm C_7\textrm H_7\textrm N\). Le calcul du nombre des centres d'insaturation donne donc ( 7 * 2 + 2 + 1 - 7 ) / 2 = 10 / 2 = 5 centres d'insaturation. Nous rencontrons ici un problème intéressant au niveau du compteur d'insaturation sur le spectre BB qui montre au maximum 4 centres (6 * 0,5 +1).
Le domaine des \(\mathrm{>C=C<}\) a été artificiellement limité à : 155 ± 5 ppm et 95 ± 5 ppm. On peut donc penser que le carbone dont le signal est à 156 ppm peut faire partie de la zone verte... Comme on compte 0,5 centre d'insaturation par carbone présent dans cette zone, si on applique cela on arrive à 7 * 0,5 = 3,5 centres d'insaturation... Petit problème... le nombre de centre d'insaturation d'un composé ne peut être qu'un entier ! Cela attire donc l'attention sur les signaux des pics aux déplacements chimiques les plus élevés, ou les plus bas de la plage ou sur la présence possible d'une liaison \(\textrm{-CN}\equiv\).
On peut alors regarder le spectre Infra Rouge si on en dispose pour confirmer la présence d'une triple liaison ou mieux puisque l'on fait de la RMN \(\textrm{}^{13}\textrm C\), regarder le spectre Off Resonance et le spectre DEPT. En effet, si on a une liaison \(\textrm{-CN}\equiv\), alors il s'agit d'un carbone quaternaire (on ne peut avoir ce carbone rattaché à un hydrogène... sinon on aurait l'acide \(\textrm{HCN}\) !). Donc, non porteur d'hydrogène, ce carbone aura pour signal un singulet dans le spectre OR et il sera absent dans le spectre DEPT. Voyons ces spectres :
Le seul signal correspondant à un carbone quaternaire est le signal à 156 ppm. Il ne peut s'agir d'un \(\textrm {-CN}\equiv\)... le signal est trop déblindé pour que ce soit ce type de carbone. on doit donc envisager une autre hypothèse.
La solution est donc d'imaginer une approche incluant un \(\mathrm {>C=N-}\). On pense donc à 3 \(\mathrm {>C=C<}\) et une \(\mathrm {>C=N-}\), donc quatre centres d'insaturation et il en manque 1, on en déduit que c'est un cycle.
3. hydrogénation : tous les \(\textrm H\) sont portés par des carbones (nous avons détaillé cette partie dans l'étude précédente du spectre Off Resonance) avec 1\(\textrm C\) quaternaire, 5 \(\textrm{CH} \)et 1 \(\textrm{CH}_2\).
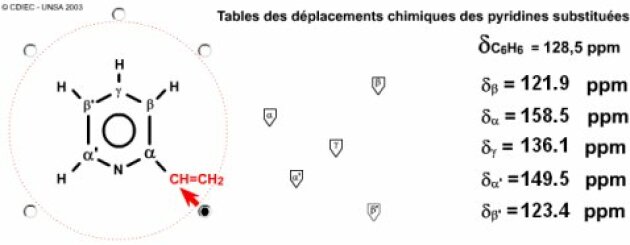
Bilan : comme un cycle ne peut intégrer le \(\textrm{=CH}_2\), on en déduit qu'il y a un substituant vinyle (\(\textrm{-CHCH}_2\)). Le cycle incluant les trois autres liaisons doubles et 1 azote, c'est donc une pyridine et plus précisemment une vinylpyridine. Trois structures candidate sont possibles
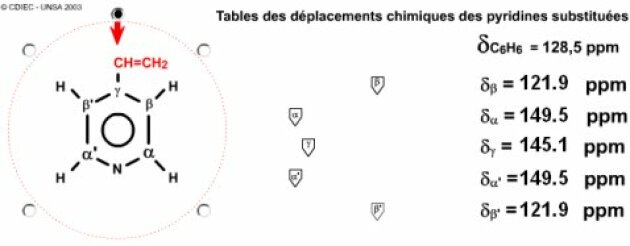
On voit immédiatement que la formule B (la \(\gamma\)-vinylpyridine) ne peut pas convenir, car il apparaît une symétrie ce qui entraîne l'isochronie de certains carbones... Reste à trancher entre la formule A : \(\alpha\)-vinylpyridine et la formule C : \(\beta\)-vinylpyridine... On trouve tout de suite en utilisant le simulateur des déplacements chimiques des pyridines polysubstituées... Classiquement, les carbones \(\alpha\) des pyridines sont nettement déblindés, il s'agit ici des carbones à 156 ppm et à 150 ppm. L'un des deux est un \(\textrm{CH} \)l'autre un \(\textrm C\) parce qu'il porte le substituant. C'est donc l' \(\alpha\)-vynilpyridine.
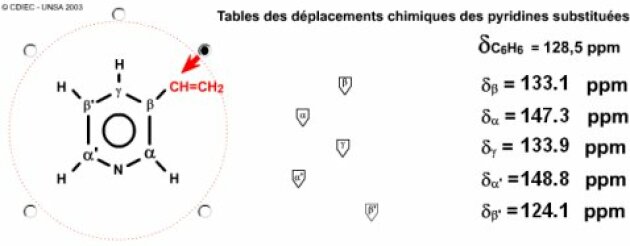
Faisons maintenant ce type d'analyse sur les différents exemples que nous avons vu précédemment.