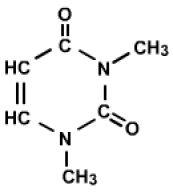
Exemple n°5 fin
Soit un composé de formule brute \(\textrm C_6\textrm H_8\textrm N_2\textrm O_4\) (4 centres d'insaturation).
Nous étions resté sur deux hypothèses
le pic à 101 pm est un carbone \(\textrm{sp}^3\) porteur de plusieurs hétéroatomes, et alors il y a un couple de carbones participant à \(\mathrm{>C=C<}\) et il reste à 163 ppm un carbone fonctionnel à déplacement chimique bas, vraisemblablement un carbone de type amide \(\mathrm{-(C=O)-N<}\).
Bilan : deux centres sont identifiés, il reste deux cycles (pas de \(\textrm{NO}_2\) possible puisque l'hypothèse de la fonction amide et la disubsitution du carbone consomment 3 ou 4 hétéroatomes) ;
les pics à 101 et 143 ppm sont de type \(\mathrm{>C=C<}\) et alors le signal à153 ppm est un carbone fonctionnel particulièrement bas (plus blindé qu'une amide).
Bilan : deux fonctions et une \(\mathrm{>C=C<}\) font trois insaturations et il resterait un cycle.
Et aucun proton n'est porté par les hétéroatomes.
Cette fois encore, on a besoin d'autres données pour établir la structure du composé. Le spectre RMN du proton est décisif, puisque on observe à 5.7 et 7.2 ppm deux doublets avec couplages fort, de type couplage cis entre les deux \(\textrm{CH} \); cela valide l'hypothèse \(\mathrm{>C=C<}\) et plus précisément \(\textrm{-CH=CH-}\). Le fort écart entre les deux déplacements chimiques de ce fragment en RMN du proton (tout comme le fort écart des déplacements chimiques de ces \(\textrm C\) en RMN du \(\textrm{}^{13}\textrm C\)) laisse prévoir un groupement donneur à une extrémité (\(\textrm N\) ou \(\textrm O\)) et un groupement accepteur à l'autre extrémité (\(\mathrm{>C=O}\)). Notez le fort blindage relatif du \(\textrm{C=O}\) encadré par deux atomes d'azote.
Formule du composé