Exemple n°1 fin
Soit un composé de formule brute \(\textrm C_5\textrm H_9\textrm{NO}_2\) (2 centres d'insaturation).
isochronie : 5 carbones et 5 signaux... pas d'isochronie.
insaturation : 2 centres d'insaturation. 1 cycle et un \(\mathrm{\succ C=O}\) ou un \(\mathrm{\succ C=N-}\).
hydrogénation : 3 \(\textrm{CH}_2\), 1 \(\textrm{CH}\) donc 7 hydrogènes, il en reste 2 à placer donc soit \(\textrm{NH}_2\), soit deux \(\textrm{OH}\), soit un \(\textrm{NH}\) et un \(\textrm{OH}\).
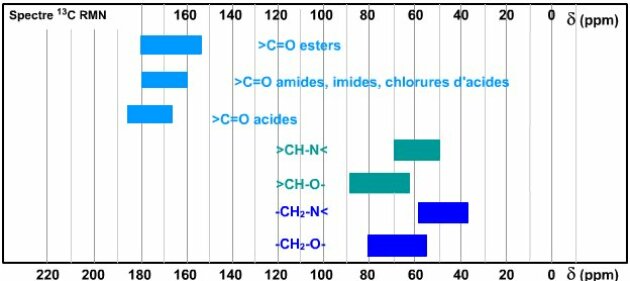
Si on regarde les déplacements chimiques, d'après les tables, le carbone quaternaire à 176 ppm donne la possibilité d'avoir soit un acide, un ester, \(\textrm{O-C=O}\), soit une amide \(\textrm{N-C=O}\). Le \(\textrm{CH} \)à 64 ppm se situe à la limite inférieure de la plage des \(\mathrm{\succ CH-O-}\) ; il est dans la plage des des \(\mathrm{>CH-N<}\). Pour le \(\textrm{CH}_2\) situé à 50 ppm, il est dans la plage des \(\textrm{-CH}_2\mathrm{-N<}\) et en-dessous de la plage des \(\textrm{-CH}_2\textrm{-O-}\).
Il s'avère donc que les spectres \(\textrm{}^{13}\textrm C\) RMN ne sont pas ici suffisants pour trouver la formule développée. Plusieurs structures candidates restent encore possibles.
L'examen du spectre RMN du proton montre la présence de deux triplets, l'un correspondant à un \(\textrm{CH} \)à 4 ppm et l'autre correspondant à un \(\textrm{CH}_2\) à 3,5 ppm. Le reste du spectre montre un massif patatoÏdique vers 7 ppm et un multiplet ininterprétable vers 2 ppm. L'analyse conduit donc à retenir un enchaînement \(\mathrm{>CH-CH}_2\textrm-\) et un autre \(\textrm{-CH}_2\textrm{-CH}_2\). Quant à l'infrarouge, le spectre montre une bande intense très large (couvrant 3300 \(\textrm{cm}^{-1}\) à 2200 \(\textrm{cm}^{-1}\)) caractéristique des acides, une bande à 1630 \(\textrm{cm}^{-1}\) et une autre à 1570 \(\textrm{cm}^{-1}\).
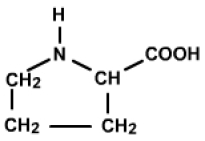
A partir de ces informations, on peut en déduire que le composé est la proline. On a donc une amine secondaire sur un cycle à 5 atomes (d'où un \(\mathrm{>NH}\)) portant un \(\textrm{COOH}\) en \(\alpha\) (d'où le \(\textrm{CH} \)déblindé par le double environnement).
Notez que le recours à des informations spectroscopiques complémentaires est souvent nécessaire, la construction totale d'une structure à partir d'une seule technique étant rarement possible et... sûre !