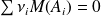La ecuación balanceada o ecuación estequiométrica
Ecuación estequiométrica
La ecuación química clásica aporta una información a la vez:
cualitativa (cuáles son las sustancias que reaccionan -los reactantes- y cuáles son las que se forman -los productos)
y cuantitativa (en qué proporción reaccionan estas sustancias entre sí). La naturaleza de los reactivos y los productos está especificada por su fórmula.
La proporción con la que reaccionan está especificada por los coeficientes estequiométricos.
Ejemplo :
Así, la ecuación:
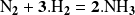 indica que:
indica que:
el nitrógeno molecular
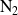 reacciona con la molécula de hidrogeno
reacciona con la molécula de hidrogeno
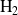 para formar amoníaco
para formar amoníaco
 ,
,Las proporciones consumidas y producidas son, respectivamente, 1, 3 y 2, las cantidades de cada sustancia están expresadas en moles.
La ecuación balanceada no aporta ninguna información acerca de la manera en que las sustancias entran en reacción a nivel molecular.
Ejemplo :
Así, en el ejemplo anterior, la ecuación balanceada
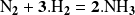 no nos proporciona ningún dato sobre las etapas de la reacción, el número de moléculas que entran en contacto en cada una de estas etapas, etcétera.
no nos proporciona ningún dato sobre las etapas de la reacción, el número de moléculas que entran en contacto en cada una de estas etapas, etcétera.
Para marcar bien la distinción entre el nivel macroscópico (representado por la ecuación balanceada) y el nivel microscópico, en la ecuación balanceada utilizaremos el signo
 para separar los reactantes (convencionalmente escritos a la izquierda) de los productos (escritos a la derecha) y reservaremos la flecha
para separar los reactantes (convencionalmente escritos a la izquierda) de los productos (escritos a la derecha) y reservaremos la flecha
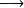 para escribir las reacciones a nivel molecular.
para escribir las reacciones a nivel molecular.
La ecuación balanceada no indica el número de moles en presencia de las distintas sustancias. Ella especifica solamente las proporciones que existen entre las moléculas que desaparecen (reactantes) y que aparecen (productos) durante la reacción.
Escritura generalizada
La escritura de la ecuación balanceada puede ser generalizada:
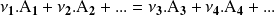
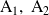 son las sustancias iniciales (reactantes)
son las sustancias iniciales (reactantes)
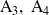 son las sustancias formadas (productos)
son las sustancias formadas (productos)
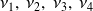 son los coeficientes estequiométricos.
son los coeficientes estequiométricos.
Para después, resulta cómodo asignar convencionalmente el signo -a los coeficientes de los reactantes (que desaparecen) y el signo + a los de los productos (que se forman). Con esta convención, el balance másico de la reacción completa se escribe:
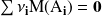
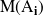 es la masa molar de la sustancia
es la masa molar de la sustancia
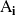 , la suma correspondiente a los reactantes y los productos.
, la suma correspondiente a los reactantes y los productos.
Ejemplo :
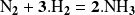
Ejemplo:
| |||
|---|---|---|---|
|
|
| |
Masa molar M | 28,0 | 2,0 | 17,0 |
Coeficientes estequiométricos con su signo
| -1 | -3 | 2 |
Aplicación de la ecuación
| -1x28,0 - 3x2,0 + 2x17,0 = 0 | ||
Consejo :
(que aunque parezcan evidentes, pueden ser útiles de recordar...)
En la ecuación balanceada tal como aparece escrita más arriba, no ponemos signo a los coeficientes estequiométricos.
En la ecuación balanceada, el símbolo = no tiene el mismo sentido que en matemáticas; fue introducido convencionalmente para reemplazar la flecha
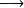 usualmente empleada para escribir las reacciones químicas.
usualmente empleada para escribir las reacciones químicas.Asimismo, el símbolo + utilizado en las ecuaciones de reacciones químicas no es el operador de adición.
En cambio, en la ecuación balanceada másica, tal como aparece escrita más arriba, los coeficientes estequiométricos tienen el signo + para los productos y el signo - para los reactantes, la suma es una suma algebraica y el resultado es igual a cero.
La ecuación balanceada no indica el número de moles en presencia de las distintas sustancias. Ella especifica solamente las proporciones que existen entre las moléculas que desaparecen (reactantes) y que aparecen (productos) durante la reacción.
Fundamental :
La ecuación balanceada no aporta ninguna información acerca de la manera en que las sustancias entran en reacción a nivel molecular. Para marcar bien la distinción entre el nivel macroscópico (representado por la ecuación balanceada) y el nivel microscópico, en la ecuación utilizaremos el signo = para separar los reactantes (convencionalmente escritos a la izquierda) de los productos (escritos a la derecha) y reservaremos la flecha para escribir las reacciones a nivel molecular.
Método :
Las cantidades de sustancias (tanto reactantes como productos) puestas en contacto en un sistema, dependen de las condiciones de operación. Cuando estas cantidades están en las mismas proporciones que los coeficientes estequiométricos, decimos, precisamente, que los reactivos están "en proporciones estequiométricas". En el caso contrario, uno de los reactantes está en exceso, el otro será limitante.
En general, el operador puede elegir las cantidades de sustancias que pone en contacto para realizar una reacción química.
Si elige las cantidades de reactivos en la misma relación que los coeficientes estequiométricos, decimos que la mezcla está "en proporción estequiométrica" o, simplemente, hablamos de "mezcla estequiométrica". En este caso,
cuando la reacción está completa, no quedarán más reactivos.
Durante la reacción, los reactivos se mantienen en las mismas proporciones.
Si elige las cantidades de reactivos en una relación diferente, habrá un reactivo en exceso y limitante. En este caso,
cuando el reactivo limitante se haya consumido completamente, la reacción se detendrá.
Durante la reacción, la proporción entre los reactivos evoluciona.