Leyes de velocidad
Definición :
Llamamos ley de velocidad a la relación entre la velocidad de reacción y las concentraciones de todas las sustancias presentes en el medio reacional, así como a todos los demás factores susceptibles de influir en la velocidad.
Esta ley de velocidad es puramente fenomenológica y debe establecerse de manera experimental.
En general, la ley de velocidad puede expresarse como un producto de dos funciones:
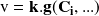
Relación en la cual
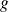 es una función de las concentraciones de las especies que participan en la reacción y
es una función de las concentraciones de las especies que participan en la reacción y
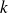 una función de los demás factores que influyen en la velocidad (temperatura, presión, disolvente, etcétera).
una función de los demás factores que influyen en la velocidad (temperatura, presión, disolvente, etcétera).
En ciertas condiciones, que son importantes de especificar,
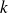 tiene un valor constante, por eso habitualmente se le llama constante de velocidad.
tiene un valor constante, por eso habitualmente se le llama constante de velocidad.
De hecho,
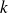 solamente es constante para estas condiciones particulares. El valor de
solamente es constante para estas condiciones particulares. El valor de
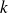 depende de la reacción estudiada y varía en gran medida con la temperatura. Otros factores pueden también ejercer una influencia, por ello, la IUPAC recomienda llamarla coeficiente de velocidad en vez de constante de velocidad. Sin embargo, esta última denominación sigue usándose en forma habitual.
depende de la reacción estudiada y varía en gran medida con la temperatura. Otros factores pueden también ejercer una influencia, por ello, la IUPAC recomienda llamarla coeficiente de velocidad en vez de constante de velocidad. Sin embargo, esta última denominación sigue usándose en forma habitual.
Ejemplo :
Para la reacción
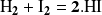
Podemos establecer que la ley de velocidad tiene la forma simple:
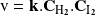
Mientras que para
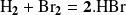
la ley de velocidad toma una forma más compleja:
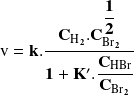
Sin embargo, teniendo en cuenta la similitud de los reactivos puestos en juego en estas reacciones, podríamos esperar que las leyes de velocidad tengan formas parecidas. Pero no es así. Este ejemplo muestra que la ley de velocidad no puede deducirse de la ecuación balanceada.
Ejemplo :
La reacción de bromación del metano en fase gaseosa bajo una fuente de luz:
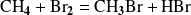
obedece a una ley de velocidad compleja que tiene la misma forma que la observada en
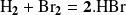
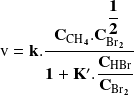
el coeficiente
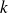 es de la forma:
es de la forma:
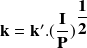
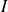 es la intensidad de la luz absorbida,
es la intensidad de la luz absorbida,
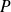 la presión total y
la presión total y
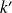 un coeficiente dependiente de la temperatura. Todas las leyes de velocidad no son tan complejas.
un coeficiente dependiente de la temperatura. Todas las leyes de velocidad no son tan complejas.
Ejemplo :
En gran cantidad de casos, la ley de velocidad toma la forma de un monomio. Así, la velocidad de la reacción de descomposición en fase gaseosa del hemipentaóxido de nitrógeno es simplemente proporcional a la concentración del reactivo:

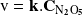
Veremos muchos más ejemplos de ley de velocidad en lo que resta del curso.






