Reacciones elementales, mecanismos
Puntos de vista macroscópico y microscópico de la reacción
En la parte anterior, introdujimos la velocidad de una reacción y los conceptos derivados (ley de velocidad y orden de reacción) a partir de las variaciones de las cantidades de reactantes o de productos observadas a lo largo del tiempo. Dicho de otra manera, aplicamos un punto de vista macroscópico.
Desde el punto de vista microscópico, la reacción se traduce a escala de las moléculas por la ruptura de ciertos enlaces y el establecimiento de otros enlaces químicos, que provocan la desaparición de los reactantes y la formación de los productos.
Reacción elemental
Cuando una reacción se realiza simplemente en una sola etapa, haciendo intervenir solamente los reactantes, decimos que se trata de una reacción elemental.
Ejemplo :
La descomposición térmica del ciclobutano en fase gaseosa en dos moléculas de etileno
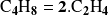 :
:




se efectúa directamente sin que hayamos podido evidenciar etapas intermedias. Por lo tanto, debemos considerarla como una reacción elemental.
Ejemplo :
La reacción
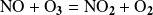 se efectúa también en una sola etapa durante la cual hay transferencia directa de un átomo de oxígeno entre las moléculas
se efectúa también en una sola etapa durante la cual hay transferencia directa de un átomo de oxígeno entre las moléculas
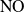 y
y
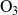 .
.
Molecularidad
Llamamos molecularidad al número de entidades químicas (moléculas, iones, radicales) que participan en una reacción elemental.
Ejemplo :
La descomposición del ciclobutano, vista más arriba, hace intervenir una sola molécula de ciclobutano durante la descomposición. La molecularidad es igual a uno. La reacción se llama unimolecular.
En cambio, en el segundo ejemplo,
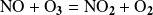 , hay participación de dos moléculas en la reacción elemental. Diremos que la molecularidad es igual a dos. Entonces, hablamos de reacción bimolecular.
, hay participación de dos moléculas en la reacción elemental. Diremos que la molecularidad es igual a dos. Entonces, hablamos de reacción bimolecular.
Las reacciones elementales bimoleculares son las más frecuentes. Las reacciones unimoleculares lo son menos. Las reacciones trimoleculares son mucho más raras, ya que solo pueden producirse cuando se encuentran tres entidades simultáneamente, lo que estadísticamente es muy improbable. No se conoce una reacción elemental de molecularidad superior a tres.
Orden y molecularidad
Hemos visto que la ley de velocidad de una reacción se establece de forma experimental a partir de las medidas de evolución de las cantidades de reactantes en función del tiempo. Por lo tanto, se trata de una expresión empírica que traduce la evolución macroscópica del sistema químico.
Cuando la ley de velocidad toma la forma simple de un monomio en función de las concentraciones, decimos que la reacción admite un orden. Llamamos orden parcial de la reacción con respecto a un reactante a la potencia que afecta a la concentración de dicho reactante en la expresión de la ley de velocidad.
Con respecto a este tema, puede repasar la parte de este capítulo titulada Orden de reacción.
Los órdenes parciales determinados de este modo, no son necesariamente iguales a los coeficientes estequiométricos de la reacción considerada. Sin embargo, si consideramos una reacción elemental, conocemos el número de entidades químicas que participan en el acto reaccional. Entonces, es posible deducir el orden de esta reacción elemental.
Por ejemplo, en el caso de una reacción bimolecular, evidentemente es necesario que las dos moléculas se encuentren (entren en contacto) para que la reacción pueda producirse. Entonces, es fácil comprender que la velocidad de reacción debe ser proporcional a la frecuencia de los encuentros entre dos clases de moléculas. Sin entrar en el detalle de la demostración, podemos establecer que la frecuencia de estos choques es proporcional a la concentración de cada reactivo. Así, para una reacción que se produce simplemente por contacto entre dos moléculas
 y
y
 , la velocidad de la reacción debe ser de esta forma:
, la velocidad de la reacción debe ser de esta forma:
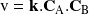
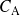 y
y
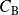 son las concentraciones de
son las concentraciones de
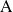 y
y
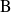 .
.
La reacción será del orden global 2. En este caso, el orden de la reacción es igual a la molecularidad de la reacción elemental.
El razonamiento que acabamos de hacer para una reacción bimolecular se aplica también a las reacciones elementales unimoleculares o trimoleculares.
Fundamental :
Concluimos, de manera general: en el caso de una reacción elemental, el orden global es igual al número de moléculas que entran en contacto (molecularidad). Además, los órdenes parciales son iguales al número de moléculas de cada especie que intervienen en el acto reaccional.
Así, la reacción de descomposición del ciclobutano que, como hemos visto, es una reacción elemental, sigue una ley de velocidad de orden 1.
Reacciones complejas
Durante el estudio de una nueva reacción, no sabemos si la misma se efectúa en una sola etapa simple o si, por el contrario, se desarrolla con la intervención de otras reacciones. Dicho de otro modo, nada nos indica a priori si se trata de una reacción elemental o no. En ciertos casos, es fácil darse cuenta de que la reacción no puede ser una reacción elemental.
Es el caso de las reacciones en las que intervienen numerosas entidades (tres o cuatro), la reacción no es ciertamente elemental puesto que los choques trimoleculares son extremadamente raros y las reacciones de molecularidad superior no son factibles.
Ejemplo :
La ecuación balanceada de la oxidación de los iones
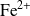 por el ion permanganato se escribe :
por el ion permanganato se escribe :
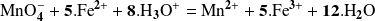
No es posible imaginar que la reacción pueda efectuarse en una sola etapa durante la cual 5 iones
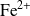 se encuentren con los 8 iones
se encuentren con los 8 iones
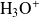 y el ion
y el ion
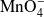 lo que formaría un conjunto de 14 entidades químicas que deberían encontrarse en el mismo lugar, en el mismo instante.
lo que formaría un conjunto de 14 entidades químicas que deberían encontrarse en el mismo lugar, en el mismo instante.
Una reacción de este tipo se desarrolla, forzosamente, en una serie de etapas más simples. El conjunto de etapas elementales que participan en el desarrollo de una reacción se llama mecanismo reaccional.
Otra situación corresponde a los casos en que la reacción no admite un orden simple y obedece a una ley de velocidad complicada. Entonces, podemos concluir que la reacción no es una reacción elemental. Efectivamente, si lo fuera, deberíamos percibir un orden observado igual a la molecularidad.
Ejemplo :
La reacción
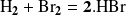 obedece a la ley de velocidad:
obedece a la ley de velocidad:
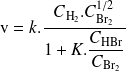
Por lo tanto, podemos estar seguros de que no se trata de una reacción elemental ya que, si fuera el caso, la ley de velocidad debería ser del primer orden en cada reactante.
Si la reacción admite un orden simple, pero que no corresponde a su estequiometría, también podemos concluir que la reacción no es elemental.
Ejemplo :
la reacción de descomposición en fase gaseosa de
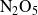 :
:
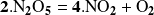
obedece a una ley del primer orden. La reacción, tal como está escrita, no es una reacción elemental bimolecular, porque si lo fuera, la ley de velocidad debería ser del segundo orden.
Cabe observar que considerando la ecuación balanceada anterior, podríamos, formalmente, dividir todos los coeficientes por 2 y escribir:

Pero esta manera de escribir la fórmula no es aceptable para una etapa elemental, ya que hace intervenir un coeficiente fraccionario. Ahora bien, ¡a nivel molecular no podemos considerar "semimoléculas"!
Queda el caso de las reacciones que obedecen a un orden simple igual a su molecularidad.
Ejemplo :
La reacción
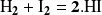 obedece a la ley de velocidad:
obedece a la ley de velocidad:
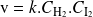
Los órdenes parciales son iguales a los coeficientes estequiométricos.
Por lo tanto, puede suceder que la reacción sea una reacción elemental, sin embargo, esto no es cierto.
Efectivamente, durante mucho tiempo se consideró que esta reacción era un ejemplo de reacción elemental bimolecular. De hecho, se realizaron estudios más precisos de la variación del coeficiente de velocidad con la temperatura, que mostraron que por encima de una temperatura del orden de 600 K convenía tener en cuenta una etapa de colisión entre un átomo de yodo y una molécula de hidrógeno. Esta observación obliga a tomar en cuenta una etapa de formación de los átomos de yodo a partir de la molécula de yodo.
Mecanismo
Llamamos mecanismo al conjunto de reacciones elementales que informan debidamente del desarrollo de una reacción. Por lo tanto, un mecanismo es una hipótesis que debe ajustarse al conjunto de observaciones experimentales disponibles. En particular, un mecanismo debe traducir correctamente la estequiometría de la reacción y ser compatible con la ley de velocidad determinada experimentalmente.
A veces, podemos proponer varios mecanismos que sean compatibles con todas las observaciones experimentales. Por ello, buscaremos concebir experiencias nuevas o perfeccionar nuevos métodos de investigación para decidir entre estos mecanismos. Pero, aunque un solo mecanismo siga siendo compatible con todos los datos experimentales, siempre deberá ser considerado como una hipótesis.
Desde el punto de vista metodológico, una hipótesis (y más generalmente una teoría científica) está siempre "en espera", solo es aceptable si no ha sido contradicha (decimos "falsificada") por nuevas observaciones. Por lo tanto, es importante comprender que nunca se puede probar que una hipótesis o una teoría sea justa. Podemos solamente fijar su ámbito de validez y la precisión con la que la misma da cuenta de las observaciones.






