Velocidad de reacción
Definición :
Definimos la velocidad de reacción como el derivado del avance
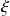 con respecto al tiempo:
con respecto al tiempo:
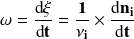
Según esta definición, la velocidad se expresa en mol.s-1. Es una magnitud extensiva; depende del tamaño del sistema.
Observación :
Como ya se ha señalado, la relación entre las cantidades transformadas y el avance de una reacción es fácil de establecer en el caso de una reacción aislada. La definición de las velocidades no plantea, entonces, ningún problema. Si una sustancia participa en varias reacciones simultáneamente, la situación es más delicada. Por lo tanto, para definir la velocidad de una reacción, hay que elegir una sustancia que sólo participe en esta reacción.
Ejemplo : Cómo expresar la velocidad de una reacción en un caso simple y establecer el vocabulario "velocidad de transformación", "velocidad de desaparición" y "velocidad de producción".
Tenemos la reacción:
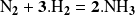
En un momento dado, la velocidad de reacción tiene un valor 0,040 mol.s-1 .
Exprese las velocidades de los distintos componentes.
Tómese el tiempo para pensar en esta pregunta, luego entre aquí para verificar sus resultados[1] .
Determinación gráfica de la velocidad de transformación y la velocidad de reacción.
La magnitud
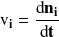 se conoce como velocidad de transformación del componente
se conoce como velocidad de transformación del componente
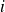 .
.
Es una magnitud algebraica positiva en el caso de los productos, negativa en el caso de los reactantes. Más específicamente, hablaremos de velocidad de formación en el caso de un producto. Para un reactante, su velocidad de transformación
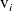 es negativa y su opuesto se conoce como velocidad de desaparición.
es negativa y su opuesto se conoce como velocidad de desaparición.
Ejemplo : Noción de velocidad volumétrica en el caso de una reacción con estequiometría diferente de 1
Consideremos, por ejemplo, la reacción:
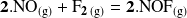
conducida en un reactor de volumen fijo
 .
.
Podemos expresar la velocidad de la reacción mediante la relación de definición
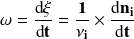
refiriéndonos a cualquiera de los reactantes o productos. El resultado se expresa en mol.s-1.
Dado que el sistema reaccional tiene un volumen fijo
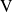 , podemos deducir la velocidad volumétrica
, podemos deducir la velocidad volumétrica
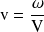 . El resultado se expresa entonces en mol.L-1.s-1.
. El resultado se expresa entonces en mol.L-1.s-1.
Para las reacciones en solución, generalmente empleamos la velocidad volumétrica por encima de la velocidad
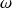 .
.
Para hacernos una idea, apliquemos estas relaciones utilizando datos numéricos particulares.
Aplicación numérica:
El matraz en el que se lleva a cabo la reacción tiene un volumen de 400 mL.
La velocidad de reacción de un momento
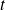 vale:
vale:
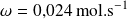 .
.
Calculemos la velocidad volumétrica de la reacción
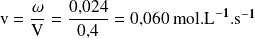
Las velocidades volumétricas de transformación de cada sustancia se calculan mediante la relación:
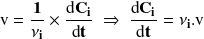
Es decir por:
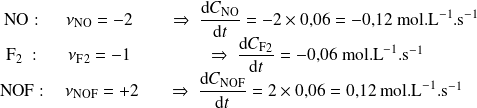
Estas velocidades son magnitudes extensivas cuyo valor no depende del tamaño del sistema, mientras que las velocidades de transformación expresadas en mol.s-1 son magnitudes extensivas.
En el caso de reacciones efectuadas en un sistema cerrado a volumen constante y, en particular, de reacciones en fase líquida, definimos una velocidad volumétrica de reacción mediante la relación:
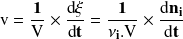 , la concentración
, la concentración
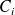 del componente
del componente
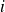 es igual a
es igual a
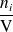 surge:
surge:
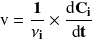
Según esta definición, la velocidad se expresa en mol.L-1.s-1.
Observación :
También podemos escribir
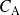 o
o
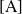 , la concentración
, la concentración
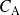 del componente
del componente
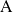 ...
...
En todo este curso, conservaremos la calificación
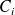 para las concentraciones de los componentes
para las concentraciones de los componentes
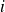 ...
...
La velocidad volumétrica es una magnitud intensiva y es independiente del tamaño del sistema. Cuando no hay ambigüedad posible, podemos omitir el calificativo "volumétrico" y está permitido hablar de velocidad de reacción empleando la definición anterior.
Ejemplo : Cómo expresar las velocidades de reacciones en el caso de varias reacciones que ocurren simultáneamente.
Consideremos las dos reacciones que se producen simultáneamente:
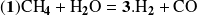
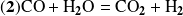
Antes de expresar las velocidades de las reacciones, examinemos cómo podemos expresar las cantidades de cada componente en un momento
 cualquiera.
cualquiera.
Es decir
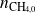 ,
,
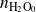 y
y
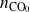 , las cantidades iniciales
, las cantidades iniciales
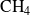 ,
,
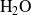 y de
y de
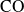 .
.
Las cantidades iniciales de
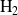 y
y
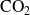 se plantean nulas.
se plantean nulas.
Es decir
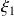 y
y
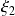 los avances de las reacciones (1) y (2) en un momento
los avances de las reacciones (1) y (2) en un momento
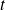 .
.
Exprese las cantidades de cada sustancia en función de las cantidades iniciales
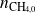 ,
,
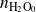 ,
,
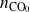 , y de los avances
, y de los avances
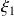 y
y
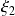 y luego, exprese las velocidades de reacción.
y luego, exprese las velocidades de reacción.
Tómese el tiempo para escribir estas relaciones antes de entrar aquí para ver los resultados[2] .
Podemos determinar la velocidad de la reacción en varios momentos y construir su curva
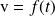 .
.
O sea una reacción
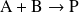 que ocurre en solución a volumen constante:
que ocurre en solución a volumen constante:
La velocidad medida para el momento
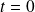 se llama velocidad inicial. En la mayor parte de los casos, corresponde a una situación en la que solo los reactantes están presentes.
se llama velocidad inicial. En la mayor parte de los casos, corresponde a una situación en la que solo los reactantes están presentes.
Observación :
La velocidad determinada mediante derivación de la curva
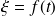 o
o
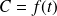 es generalmente menos precisa que las medidas de
es generalmente menos precisa que las medidas de
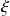 o de
o de
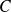 que sirvieron para determinarla. La velocidad inicial se obtiene por extrapolación en el origen de la curva
que sirvieron para determinarla. La velocidad inicial se obtiene por extrapolación en el origen de la curva
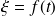 es aún menos precisa. De todos modos, cabe destacar que tomando ciertas precauciones, es posible determinar los valores de las velocidades con buena precisión.
es aún menos precisa. De todos modos, cabe destacar que tomando ciertas precauciones, es posible determinar los valores de las velocidades con buena precisión.






