Avance de reacción
Definición :
Para poder estudiar la evolución de la reacción en función del tiempo y no conformarse con conocer su estado inicial y su estado final, hay que definir su avance con precisión en todo momento. Si tenemos
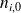 moles de
moles de
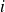 en el momento inicial
en el momento inicial
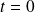 y
y
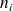 moles en el momento
moles en el momento
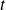 , definimos el avance de la reacción en ese momento
, definimos el avance de la reacción en ese momento
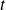 con:
con:
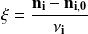
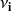 es el coeficiente estequiométrico de
es el coeficiente estequiométrico de
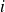 (con el signo + para los productos y el signo – para los reactantes).
(con el signo + para los productos y el signo – para los reactantes).
Cuando la sustancia considerada es un reactante, su cantidad disminuye durante la reacción. Por lo tanto
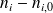 es negativo. Por convención, se asigna el coeficiente estequiométrico
es negativo. Por convención, se asigna el coeficiente estequiométrico
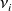 con el signo menos; como resultado, el avance de la reacción
con el signo menos; como resultado, el avance de la reacción
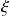 es positivo.
es positivo.Cuando la sustancia considerada es un producto (
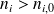 ), su cantidad aumenta durante la reacción. Por lo tanto,
), su cantidad aumenta durante la reacción. Por lo tanto,
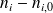 es positivo. El coeficiente estequiométrico
es positivo. El coeficiente estequiométrico
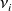 tiene el signo más; como resultado, el avance de la reacción
tiene el signo más; como resultado, el avance de la reacción
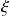 es positivo.
es positivo.
Consejo :
Como su nombre lo indica, el valor de avance de la reacción aumenta
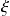 cuando la reacción avanza.
cuando la reacción avanza.La dimensión de
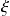 es la de una cantidad de materia, por lo tanto, es una magnitud extensiva. La unidad en el sistema internacional es el mol.
es la de una cantidad de materia, por lo tanto, es una magnitud extensiva. La unidad en el sistema internacional es el mol.El valor de avance de la reacción
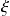 no depende de la elección de la sustancia (reactivo o producto) utilizada para calcularlo (por otra parte, es su principal interés).
no depende de la elección de la sustancia (reactivo o producto) utilizada para calcularlo (por otra parte, es su principal interés). En la práctica, para calcular el avance de la reacción, utilizamos la sustancia más fácil de dosificar. Pero ATENCIÓN, esto solo es así si la reacción es la única que deja intervenir los reactivos y los productos considerados (decimos que la reacción es aislada) y si no hay productos intermedios formados.
El hecho de que el avance sea de una magnitud extensiva tiene como consecuencia que, para una misma cantidad de materia transformada, el valor de
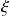 depende de los coeficientes estequiométricos, por lo tanto, de la manera de escribir la ecuación química.
depende de los coeficientes estequiométricos, por lo tanto, de la manera de escribir la ecuación química.
Nota: esta noción de avance de la reacción está desarrollada en el módulo: "Termodinámica química".
Ejemplo : El valor de avance de la reacción no depende de la elección de la sustancia (reactante o producto) utilizada para calcularlo
Consideremos la reacción de combustión del etano:
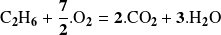
Consideremos al principio, 3 moles de etano en un exceso de oxígeno molecular.
Calculemos el avance
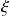 de la reacción cuando 2 moles de etano reaccionaron. Primeramente, hagamos el cálculo para el etano. Cuando 2 moles de etano se han consumiedo, queda 1 mol de etano.
de la reacción cuando 2 moles de etano reaccionaron. Primeramente, hagamos el cálculo para el etano. Cuando 2 moles de etano se han consumiedo, queda 1 mol de etano.
Donde:
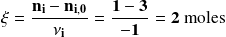
Ahora, hagamos el cálculo para el oxígeno molecular. La cantidad de oxígeno molecular consumido es igual a la cantidad de etano (2 moles) que reaccionaron, multiplicado por
 , o sea:
, o sea:
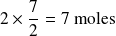 .
.
Donde:
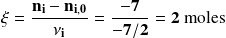
Por lo tanto, encontramos el mismo grado de avance de la reacción, sea cual sea la sustancia elegida para calcularlo.
Encontraríamos el mismo resultado haciendo el cálculo con los productos.
Cálculo con
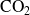 :
:
La cantidad de
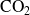 formada es igual al doble de la cantidad de etano desaparecida, es decir,
formada es igual al doble de la cantidad de etano desaparecida, es decir,
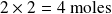 .
.
Donde
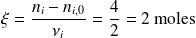
Cálculo con
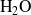 :
:
La cantidad de
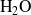 formada es el triple de la cantidad de etano desaparecida, es decir,
formada es el triple de la cantidad de etano desaparecida, es decir,
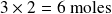 .
.
Donde
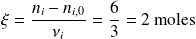
Ejemplo : Cuando una sustancia (reactante o producto) interviene en varias reacciones, el grado de avance depende de la elecciónde la sustancia de la sustancia utilizada para calcularlo.
Cuando una reacción es aislada, el grado de avance de la reacción no depende de la elección de la sustancia (reactante o producto) utilizada para calcularlo. Esto no es así cuando un mismo reactante (o producto) interviene en varias reacciones que ocurren simultáneamente. Por ejemplo, consideremos el caso de la combustión de una mezcla de metano y etano. Las dos reacciones ocurren simultáneamente y pueden escribirse:
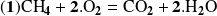
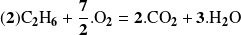
Para calcular el avance de las dos reacciones, hay que conocer las cantidades transformadas de los reactantes o de los productos. Por ejemplo, una mezcla de 0,5 moles de metano
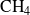 y de un mol de etano
y de un mol de etano
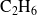 que reaccionan completamente en un exceso de oxígeno. Las cantidades transformadas son:
que reaccionan completamente en un exceso de oxígeno. Las cantidades transformadas son:
CH4 | C2H6 | O2 | CO2 | H2O | |
|---|---|---|---|---|---|
ni - ni, 0 | - 0,5 | - 1,0 | - 4,5 | 2,5 | 4,0 |
Trate de encontrar estos resultados intermedios usted mismo.
Si sabe encontrar estos valores, pase al cálculo del avance de las reacciones.
Si no logra encontrar estos valores, proceda en varias etapas, tratando de completar el cuadro que aparece más abajo. Efectivamente, para calcular las cantidades transformadas, es útil llenar un cuadro con las cantidades iniciales (
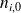 ), restantes (
), restantes (
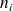 ) et (
) et (
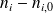 ) transformadas de cada sustancia:
) transformadas de cada sustancia:
CH4 | C2H6 | O2 | CO2 | H2O | |
|---|---|---|---|---|---|
ni,0 | |||||
ni | |||||
ni - ni,0 |
Haga clic en el avance para obtener el detalle del modo de cálculo de las reacciones... pero tómese el tiempo para tratar de encontrar estos resultados...
Cabe destacar que ciertos reactivos participan solamente en una sola de las dos reacciones.
Es el caso del metano
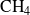 en la primera reacción y del etano
en la primera reacción y del etano
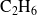 en la segunda. Por lo tanto, es posible calcular separadamente el avance de cada reacción basándose únicamente en las cantidades transformadas de estos reactivos.
en la segunda. Por lo tanto, es posible calcular separadamente el avance de cada reacción basándose únicamente en las cantidades transformadas de estos reactivos.
Para la reacción (1), obtenemos:
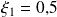
Para la reacción (2), obtenemos:
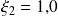
En los compuestos que participan en las dos reacciones, es fácil relacionar su cantidad transformada con los grados de avance de ambas reacciones:
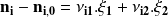
Apliquemos esta relación a los otros componentes del sistema, evidentemente, encontramos los valores calculados anteriormente.
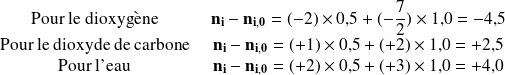
Ejemplo : Dado que el grado de avance de la reacción es de una magnitud extensiva, su valor depende de la escritura de la ecuación balanceada.
Consideremos, por ejemplo, una mezcla compuesta de un mol de acetileno y dos moles de oxígeno molecular
Calculemos el grado de avance de la reacción cuando la reacción ha terminado.
La ecuación balanceada de la reacción puede escribirse:
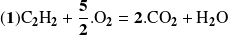
Pero también puede escribirse:
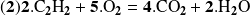
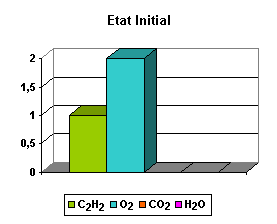
Calculemos el grado de avance de la reacción cuando la reacción ha terminado.
Con la ecuación (1), encontramos:
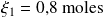
Con la ecuación (2), encontramos:
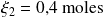
Para calcular el grado de avance
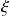 necesitamos conocer las cantidades transformadas de cada sustancia. Evidentemente, estas cantidades no dependen de la escritura de la ecuación balanceada. Pero no sucede lo mismo con el avance
necesitamos conocer las cantidades transformadas de cada sustancia. Evidentemente, estas cantidades no dependen de la escritura de la ecuación balanceada. Pero no sucede lo mismo con el avance
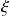 ya que, para una misma sustancia, los coeficientes estequiométricos son diferentes en las dos ecuaciones. Trate de encontrar usted mismo los valores de
ya que, para una misma sustancia, los coeficientes estequiométricos son diferentes en las dos ecuaciones. Trate de encontrar usted mismo los valores de
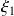 y
y
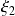 .
.
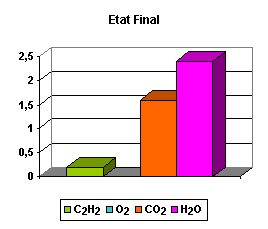
Para calcular el grado de avance, primero hay que determinar las cantidades transformadas de cada sustancia. Encontramos las cantidades transformadas siguientes:
C2H2 | O2 | CO2 | H 2O | |
|---|---|---|---|---|
ni - ni,0 | - 0,8 | - 2,0 | + 1,6 | + 0,8 |
Si desea obtener detalles acerca de estos cálculos de las cantidades transformadas entre aquí[1] .
Las cantidades de sustancias transformadas (por lo tanto, las cantidades restantes) no dependen de la manera en que escribimos la ecuación balanceada. Pero no ocurre lo mismo en el caso del avance de la reacción, ya que los coeficientes estequiométricos para cada sustancia son diferentes en las dos ecuaciones.
Retomemos el cuadro de las cantidades de sustancias transformadas:
C2H2 | O2 | CO2 | H 2O | |
|---|---|---|---|---|
ni - ni,0 | - 0,8 | - 2,0 | + 1,6 | + 0,8 |
Calcule el avance de la reacción utilizando la ecuación balanceada:
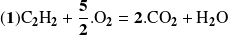
Ahora, retome el cálculo con la ecuación:
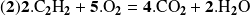
Entre aquí[2]
para ver los resultados. Encontramos
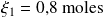 con la ecuación (1) y
con la ecuación (1) y
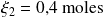 con la ecuación (2). Puede ver que, para las mismas cantidades de materia transformadas, el grado de avance de la reacción depende de la manera en que escribimos la ecuación balanceada. Esto es normal, ya que la expresión del avance hace intervenir los coeficientes estequiométricos, los cuales dependen de la ecuación balanceada.
con la ecuación (2). Puede ver que, para las mismas cantidades de materia transformadas, el grado de avance de la reacción depende de la manera en que escribimos la ecuación balanceada. Esto es normal, ya que la expresión del avance hace intervenir los coeficientes estequiométricos, los cuales dependen de la ecuación balanceada.
En conclusión:
El grado de avance de una reacción no depende del componente elegido para calcularlo, sino de la escritura de la ecuación balanceada. Por lo tanto, no podemos disociar el grado de avance de una reacción de la ecuación balanceada que sirvió para calcularlo.






