Alcanes fonctionnalisés
Nous avons vu que l'électronégativité, la polarisation des liaisons, jouent un rôle similaire de celui observé en RMN du proton, c'est à dire un déblindage important en \(\alpha\), moindre en \(\beta\), à la condition que l'atome lié soit plus électronégatif que le carbone et qu'il n'introduise pas le blindage lié aux gros atomes (cas de l'iode par exemple).
Cas des alcools
Ces deux conditions sont vérifiées pour le \(\textrm{OH}\), donc dans le cas des alcools : Incréments à ajouter au déplacement chimique de l'alcane correspondant (insertion de \(\textrm O\) dans une \(\textrm{C-H}\))
\(\alpha\) | \(\beta\) | \(\gamma\) | |
alcool I | 48.3 | 10.2 | -5.8 |
alcool II | 44.5 | 9.7 | -3.3 |
alcool III | 39.7 | 7.3 | -1.8 |
Les variations observées pour les différentes classes d'alcools traduisent des évolutions de conformation du à l'augmentation de l'effet stérique. Ainsi l'effet \(\gamma\) est plus faible pour les molécules déjà fortement encombrées. On retiendra un effet \(\alpha\) très déblindant (plage de \(\delta\) allant de 50 à 90 ppm), un effet \(\beta\) encore notable de l'ordre de 10 ppm et un effet \(\gamma\) légèrement blindant.
Autres substitutions
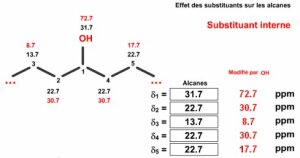
Selon la position du substituant, terminal ou interne, l'incrément peut être différent. On voit encore que la substitution est déblindante en position \(\alpha\) ou \(\beta\) mais blindante en position \(\gamma\). Ces différents incréments ont été déterminés pour le calcul des déplacements chimiques des alcanes fonctionnalisés.
Groupes | \(\alpha~\mathrm {terminal}\) | \(\beta~\mathrm {terminal}\) | \(\alpha~\mathrm {interne}\) | \(\beta~\mathrm {interne}\) | \(\gamma\) |
\(\mathrm{-CH_3}\) | 9 | 10 | 6 | 8 | -2 |
\(\mathrm{-CH=CH_2}\) | 20 | 6 | 0 | 0 | -0.5 |
\(\mathrm{-C\equiv C-H}\) | 4.5 | 5.5 | 0 | 0 | -3.5 |
\(\mathrm{-C_6H_5}\) | 23 | 9 | 17 | 7 | -2 |
\(\mathrm{-CN}\) | 4 | 3 | 1 | 3 | -3 |
\(\mathrm{-COOH}\) | 21 | 3 | 16 | 2 | -2 |
\(\mathrm{-COO^-}\) | 25 | 5 | 20 | 3 | -2 |
\(\mathrm{-COOR}\) | 20 | 3 | 17 | 2 | -2 |
\(\mathrm{-COCl}\) | 33 | 0 | 28 | 2 | 0 |
\(\mathrm{-CONH_2}\) | 22 | 2.5 | 0 | 0 | -0.5 |
\(\mathrm{-COR}\) | 30 | 1 | 24 | 1 | -2 |
\(\mathrm{-CHO}\) | 31 | 0 | 0 | 0 | -2 |
\(\mathrm{-OH}\) | 48 | 10 | 41 | 8 | -5 |
\(\mathrm{-OR}\) | 58 | 8 | 51 | 5 | -4 |
\(\mathrm{-OCOR}\) | 51 | 6 | 45 | 5 | -3 |
\(\mathrm{-SH}\) | 11 | 12 | 11 | 11 | -4 |
\(\mathrm{-SR}\) | 20 | 7 | 0 | 0 | -3 |
\(\mathrm{-NH_2}\) | 29 | 11 | 24 | 10 | -5 |
\(\mathrm{-NH_3^+}\) | 26 | 8 | 24 | 6 | -5 |
\(\mathrm{-NHR}\) | 37 | 8 | 1 | 6 | -4 |
\(\mathrm{-NR_2}\) | 42 | 6 | 0 | 0 | -3 |
\(\mathrm{-NR_3^+}\) | 31 | 5 | 0 | 0 | -7 |
\(\mathrm{-NO_2}\) | 63 | 4 | 57 | 4 | 0 |
\(\mathrm{-F}\) | 68 | 9 | 63 | 6 | -4 |
\(\mathrm{-Cl}\) | 31 | 11 | 32 | 10 | -4 |
\(\mathrm{-Br}\) | 20 | 11 | 25 | 10 | -3 |
\(\mathrm{-I}\) | -6 | 11 | 4 | 12 | -1 |
Sur la base de ces incréments, nous avons construit un simulateur de calcul.
Pour l'utiliser, vous devez en premier choisir l'alcane de référence, entrer les valeurs observées pour les déplacements chimiques des carbones de cet alcane puis choisir la fonction substituante.
Exemples
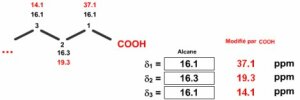
Calculez les déplacements chimiques des carbones de l'acide butanoïque \(\textrm{CH}_3\textrm{-CH}_2\textrm{-CH}_2\textrm{-COOH}\).
Il s'agit d'un alcane linéaire avec un substituant terminal. L'alcane de départ est le propane \(\textrm{CH}_3\textrm{-CH}_2\textrm{-CH}_2\textrm{-H}\) auquel on va substituer l'hydrogène terminal par le groupe \(\textrm{COOH}\). Il faut donc entrer les valeurs des déplacements chimiques observés pour les trois carbones du propane et ensuite appliquer les incréments pour le \(\textrm{COOH}\).
Alcane de départ
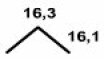
\(\textrm{CH}_3\textrm{-CH}_2\textrm{-CH}_2\textrm{-H}\)
Incréments à rajouter pour \(\textrm{-COOH}\)
\(\alpha\) = +21; \(\beta\) =+3 ; \(\gamma\) =- 2
\(\textrm{CH}_3\textrm{-CH}_2\textrm{-CH}_2\textrm{-COOH}\)
Calculez les déplacements chimiques des carbones de l'acide butanoïque \(\textrm{CH}_3\textrm{-CH}_2\textrm{-CH(OH)-CH}_2\textrm{-CH}_3\).
Il s'agit d'un alcane linéaire avec un substituant interne. L'alcane de départ est le pentane \(\textrm{CH}_3\textrm{-CH}_2\textrm{-CH}_2\textrm{-CH}_2\textrm{-CH}_3\) auquel on va substituer un hydrogène du méthylène \(\textrm{CH}_2\) central par le groupe \(\textrm{OH}\). Il faut donc entrer les valeurs des déplacements chimiques observés pour les trois carbones du prentane et ensuite appliquer les incréments pour le \(\textrm{OH}\).
Alcane de départ
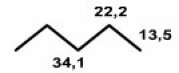
\(\textrm{CH}_3\textrm{-CH}_2\textrm{-CH}_2\textrm{-CH}_2\textrm{-CH}_3\)
Incréments à rajouter pour \(\textrm{-OH}\) \(\)
\(\alpha\) =+41 ; \(\beta\)=+8 ; \(\gamma\)=- 5
\(\textrm{CH}_3\textrm{-CH}_2\textrm{-CH(OH)-CH}_2\textrm{-CH}_3\)
Alcanes disubstitués
Dans le cas des alcanes disubstitués, on procède de la même manière pour effectuer le calcul des prévisions des déplacemenrs chimiques.
On regarde les déplacements chimiques de l'alcane correspondant, on applique les incréments aux positions \(\alpha\), \(\beta\) et \(\gamma\) du côté de ce substituant, on mémorise les nouveaux déplacements chimiques. On substitue alors le dérivé formé avec le deuxième substituant et on applique les incréments correspondant à cette deuxième fonction aux positions \(\alpha\), \(\beta\) et \(\gamma\) du côté de ce nouveau substituant.
On obtent alors les prévisions de déplacements chimiques correspondant à l'alcane disubstitué. Partant de ce proncipe de calcul, nous avons construit un simulateur des prévisions des déplacements chimiques pour les alcanes disubstitués. Ce simulateur est opérationnel à partir des alcanes linéaires de base, à savoir, méthane, éthane, propane, butane et pentane. Connaissant le mode de calcul exposé ci-dessus, vous pouvez l'appliquer à n'importe quel autre alcane.
Vous trouverez une multitude d'application de ce simulateur dans la partie "S'exercer".