Calorimètre et calorimétrie
La calorimétrie est une technique qui consiste à réaliser une transformation dans un système adiabatique[1] et à mesurer les variations de température qui accompagnent cette transformation.
De ces variations de température, on peut déduire les chaleurs de réaction[2] associées à la transformation.
Définition :

Un calorimètre est un système isolé donc adiabatique à l'intérieur duquel les transformations effectuées s'accompagneront donc d'un bilan thermique nul.
Pratiquement, un calorimètre est un récipient dont les parois de verre argentées sont doubles : on a soigneusement fait le vide entre les deux parois de verre avant de souder l'orifice par lequel on faisait le vide.
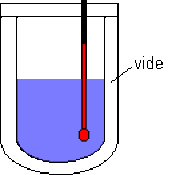
L'absence de matière (donc le vide ) empêchant la conduction de la chaleur, les pertes thermiques à travers la paroi sont très faibles. Un bouchon de liège (mauvais conducteur de la chaleur ) limite les pertes thermiques par le haut du calorimètre.
Dans la vie quotidienne, les bouteilles isothermes "thermos" sont d'assez bons calorimètres. Au laboratoire les calorimètres sont appelés "vases Dewar " du nom du scientifique qui les a conçus.
Le fait que le bilan thermique soit nul, c'est à dire que \(\Delta H = \Delta U = 0\) au cours de la transformation ne signifie nullement que ces transformations seront isothermes[3] mais que l'intégralité de la chaleur mise en jeu servira à modifier la température[4] du système.
Ainsi, pour une transformation exothermique[5], (qui dégage de la chaleur), il y aura augmentation de la température du système.