Energies de liaison
Les tables d'enthalpies standard de formation ne sont pas les seules sources d'information pour calculer des enthalpies de réaction. Il existe également des tables d'énergies de liaison.
Énergie de liaison.
L'énergie de liaison correspond à la variation d'enthalpie correspondant à la formation d'une liaison.
Par exemple, l'énergie de la liaison \(\textrm{Cl}-\textrm{Cl}\) correspond à l'enthalpie de la réaction :
\(\textrm{Cl (g)} + \textrm{Cl (g)}\to \textrm{Cl}_2\textrm{ (g)}\)
pour laquelle \(\Delta_\textrm rH^{\circ}_{298} = E_{L,298} = - \textrm{242,4 kJ}\).
L'animation ci-dessous illustre le phénomène mis en jeu lors de la formation d'une liaison carbone-carbone :
Impossible d'accéder à la ressource audio ou vidéo à l'adresse :
La ressource n'est plus disponible ou vous n'êtes pas autorisé à y accéder. Veuillez vérifier votre accès puis recharger le média.
Les énergies de liaison sont compilées dans des tables.
Ces énergies de liaison peuvent servir à calculer la variation d'enthalpie de réaction.
Calcul d'un ΔfH°298 à partir des énergies de liaison.
L'application de la loi de Hess au cycle ci-dessous permet de retrouver la relation :
\(\Delta_\textrm rH^{\circ}_{298} = \sum E_{L, 298,\textrm{ liaisons des produits finaux}} - \sum E_{L, 298,\textrm{ liaisons des réactifs initiaux}}\)
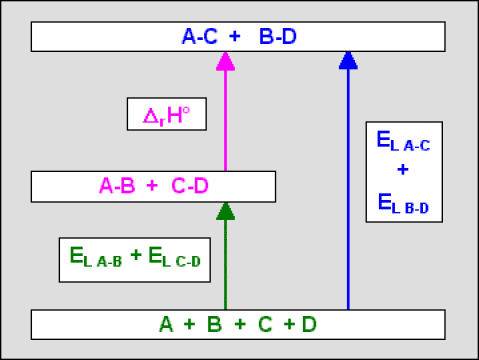
On voit en effet que dans le cycle ci-contre si l'on part d'un état dans lequel tous les éléments sont sous forme d'atomes non liés entre eux, \(\textrm A\), \(\textrm B\), \(\textrm C\) et \(\textrm D\), on démontre simplement la relation :
\(\Delta_\textrm rH^{\circ} = E_{L \textrm{ AC}} + E_{L\textrm{ BD}} - E_{L\textrm{ AB}} - E_{L\textrm{ CD}}\)
Les tables d'énergie de liaison ne permettent pas une détermination très précise des grandeurs de réaction : ces énergies sont en effet des valeurs moyennes d'énergie de liaison entachées de quelques pour cent d'erreur. Par exemple, l'énergie de la liaison \(\textrm C-\textrm O\) ne sera pas exactement la même dans un alcool primaire, secondaire ou tertiaire.