Calcul de l'enthalpie standard de réaction à 298 K
Soit une transformation \(\textrm{AB} + \textrm{CD}\to \textrm{AC} + \textrm{BD}\).
Si les corps simples[2] sous leur forme moléculaire la plus simple ont pour formule chimique \(\textrm A_2\), \(\textrm B_2\), \(\textrm C_2\) et \(\textrm D_2\), l'application de la loi de Hess[3] au cycle ci-dessous :
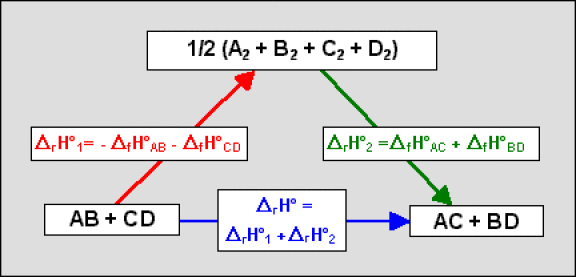
conduit à la relation générale :
\(\Delta_\textrm r H^{\circ}_{298} = \sum \Delta_\textrm f H^{\circ}_{298,\textrm{ produits finaux}} - \sum \Delta_\textrm f H^{\circ}_{298,\textrm{ réactifs initiaux}}\)
Il suffit donc de disposer des tables d'enthalpie de formation à 298 K pour calculer la variation d' enthalpie[4] associée à n'importe qu'elle réaction chimique à cette même température.
Notez que l'utilisation de la notation \(\displaystyle{\sum_i} n_i \textrm X_i = 0\) [5]pour écrire la réaction chimique permet de simplifier la relation ci dessus puisque cette dernière s'écrit alors :
\(\Delta_\textrm r H^{\circ}_{298} = \displaystyle{\sum_i} n_i.\Delta_\textrm f H^{\circ}_{298,\textrm{ i}}\)